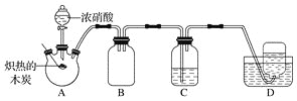
题目内容
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图:
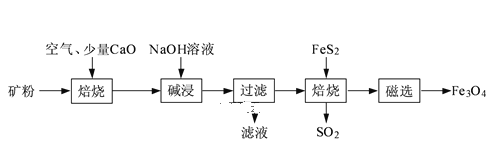
(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为____。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题图所示。
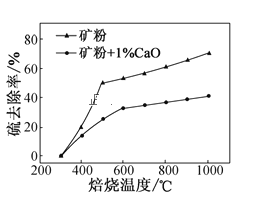
已知:多数金属硫酸盐的分解温度都高于600℃
硫去除率=(1![]() )×100%
)×100%
①不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于____。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是___。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由___(填化学式)转化为____(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与Al混合在高温下发生的反应方程式____。
【答案】SO2+OH=HSO3 FeS2 硫元素转化为CaSO4而留在矿粉中 NaAlO2 Al(OH)3 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
【解析】
高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)粉碎后通入空气、加入氧化钙焙烧,氧化钙和二氧化硫反应生成亚硫酸钙,亚硫酸钙氧化成硫酸钙和二氧化硅反应生成硅酸钙,产物加入氢氧化钠溶液碱浸,氧化铝溶解生成偏铝酸钠溶液,过滤得到溶液X为四羟基合铝酸钠溶液,经操作Ⅰ得到的固体中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2。
(1)用NaOH溶液吸收过量SO2生成亚硫酸氢钠;
(2)①不添加CaO的矿粉中S元素来源是FeS2和金属硫酸盐,金属硫酸盐的分解温度较高;
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,考虑加入CaO可能使S转化为CaSO4,形成的硫酸盐分解温度较高;
(3)过滤前使用NaOH溶液进行碱浸,Al2O3转化为NaAlO2,“过滤”得到的滤液中主要含有AlO2-,向“过滤”得到的滤液中通入过量CO2,可以将AlO2-转化为Al(OH)3;
(4)“过滤”得到的滤渣中含大量的Fe2O3,Fe2O3和铝发生铝热反应生成三氧化二铝和铁。
(1)焙烧过程均会产生SO2,是酸性氧化物,用NaOH溶液吸收过量SO2生成亚硫酸氢钠,离子方程式为:SO2+OH=HSO3;
(2)①不添加CaO的矿粉中S元素来源是FeS2和金属硫酸盐,金属硫酸盐的分解温度较高,所以可判断焙烧过程中S元素主要来源是FeS2;
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,考虑加入CaO可能使S转化为CaSO4,形成的硫酸盐分解温度较高,所以会导致S的脱除率降低;
(3)过滤前使用NaOH溶液进行碱浸,Al2O3转化为NaAlO2,再向“过滤”得到的滤液中通入过量CO2,可以将AlO2-转化为Al(OH)3,Al(OH)3再加热分解生成Al2O3;
(4)“过滤”得到的滤渣中含大量的Fe2O3,Fe2O3和铝发生铝热反应生成三氧化二铝和铁,2Al+Fe2O3![]() 2Fe+Al2O3。
2Fe+Al2O3。

 名校课堂系列答案
名校课堂系列答案【题目】硫代硫酸钠(![]() )是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生
)是一种解毒药,用于氰化物、砷、汞、铅、铋、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症。硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生![]() 和
和![]() 。
。
实验Ⅰ.![]() 的制备。工业上可用反应:
的制备。工业上可用反应:![]() 制得,实验室模拟该工业过程的装置如图所示。
制得,实验室模拟该工业过程的装置如图所示。

(1)仪器a的名称是__________,仪器b的名称是_____________。b中利用质量分数为70%~80%的![]() 溶液与
溶液与![]() 固体反应制备
固体反应制备![]() 反应的化学方程式为_______________________。c中试剂为________。
反应的化学方程式为_______________________。c中试剂为________。
(2)实验中要控制![]() 的生成速率,可以采取的措施有_________________________(写出一条)。
的生成速率,可以采取的措施有_________________________(写出一条)。
(3)为了保证硫代硫酸钠的产量,实验中通入的![]() 不能过量,原因是_________________________。
不能过量,原因是_________________________。
实验Ⅱ.探究![]() 与金属阳离子的氧化还原反应。
与金属阳离子的氧化还原反应。
资料:![]() (紫黑色)
(紫黑色)
装置 | 试剂X | 实验现象 |
|
| 混合后溶液先变成紫黑色,30s后溶液几乎变为无色 |
(4)根据上述实验现象,初步判断最终![]() 被
被![]() 还原为
还原为![]() ,通过________________________(填操作、试剂和现象),进一步证实生成了
,通过________________________(填操作、试剂和现象),进一步证实生成了![]()