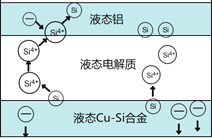
题目内容
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )
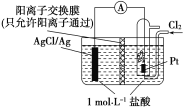
A. 负极反应为Ag-e-===Ag+
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
【答案】D
【解析】
依据电池总反应为2Ag+Cl2===2AgCl可知,通入氯气的Pt极发生得电子的还原反应作正极,其电极反应式为:Cl2+2e-=2Cl-;AgCl/Ag电极为负极,发生电极反应为:Ag-2e-+Cl-=AgCl,由于阳离子交换膜只允许阳离子通过,则盐酸中的H+向阳离子交换膜右侧移动,结合原电池的工作原理作答。
A. 根据上述分析可知,负极电极反应式为:Ag-2e-+Cl-=AgCl,A项错误;
B. 放电时,交换膜左侧溶液中会有大量氯化银白色沉淀生成,B项错误;
C. 若用NaCl溶液代替盐酸,因从反应跟溶液的酸碱性无关,则电池总反应不变,C项错误;
D. 当电路中转移0.01 mol e-时,交换膜左侧产生0.01 mol Ag+与盐酸反应产生AgCl沉淀,同时约有0.01 mol H+通过阳离子交换膜转移到右侧溶液中,故左侧溶液共约0.02 mol离子减少,D项正确;
答案选D。

练习册系列答案
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目