题目内容
【题目】Ni常被镀在金属制品上以保护金属不生锈。
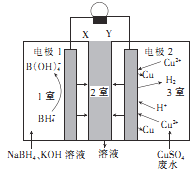
(1)镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。
①待镀零件与电源___________相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)____Ni2++____H2PO2-+_____→___Ni ++______H2PO3-+____,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑![]()
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。______________
(2)LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2,该反应的化学方程式为________________,加热温度不宜过高的原因是________________________,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是____________。
(3)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:
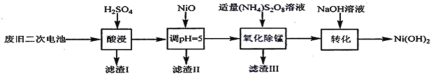
已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii._____________________________________(用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?____________(列式计算,并使用必要的文字说明)。
【答案】负极 2、1、1H2O、2、1、2H+ 4Ni(OH)2+4LiOH+O2![]() 4LiNiO2+6H2O 防止温度高于850℃时LiNiO2分解 产生氮氧化物,污染环境 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ pH=5,滤液中c(OH-)=10-9mol/L,Qc=c2(OH-)·c(Ni2+)=2×10-18<Ksp[Ni(OH)2]=1.6×10-14,故无Ni(OH)2沉淀产生。
4LiNiO2+6H2O 防止温度高于850℃时LiNiO2分解 产生氮氧化物,污染环境 2MnO4-+3Mn2++2H2O=5MnO2↓+4H+ pH=5,滤液中c(OH-)=10-9mol/L,Qc=c2(OH-)·c(Ni2+)=2×10-18<Ksp[Ni(OH)2]=1.6×10-14,故无Ni(OH)2沉淀产生。
【解析】
废旧二次电池加入硫酸,结合题目信息可知,酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+,过滤得到残渣I为炭粉;滤液中加入NiO调节溶液pH,使溶液中Al3+、Fe3+转化为Al(OH)3、Fe(OH)3沉淀,过滤分离出滤渣II为Al(OH)3、Fe(OH)3,氧化除去锰离子,过滤分离出滤渣III为MnO2,滤液中加NaOH生成Ni(OH)2.过滤分离得到Ni(OH)2,以此来解答。
(1)①电镀镍的过程中Ni2+要在镀件上被还原生成Ni单质,所以镀件为阴极,与电源负极相连;
②根据题目给出的部分反应物和生成物可知该过程中Ni2+被还原成Ni+,化合价降低1价,H2PO2-被氧化成H2PO3-,化合价升高2价,所以二者的系数比为2:1,结合元素守恒可知方程式为2Ni2++1H2PO2-+1H2O=2Ni++1H2PO3-+2H+;
(2)已知反应物有Ni(OH)2与LiOH,产物为LiNiO2,该过程中Ni元素被氧化,根据“在空气流中加热”可知氧化剂应为氧气,结合电子守恒和元素守恒可得方程式为:4Ni(OH)2+4LiOH+O2![]() 4LiNiO2+6H2O;根据题目信息可知温度高于850℃时LiNiO2分解;LiNO3中硝酸根具有氧化性,反应中硝酸根被还原会生成氮氧化物污染环境;
4LiNiO2+6H2O;根据题目信息可知温度高于850℃时LiNiO2分解;LiNO3中硝酸根具有氧化性,反应中硝酸根被还原会生成氮氧化物污染环境;
(3)氧化除锰”是将锰元素最终转化为MnO2而除去,反应i中锰元素转化为MnO4-,需要将其还原得到MnO2,根据各元素价态变化规律和元素守恒可知该过程中MnO4-和Mn2+发生归中反应,方程式为2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(4)pH=5,滤液中c(OH-)=10-9mol/L,Qc=c2(OH-)·c(Ni2+)=2×10-18<Ksp[Ni(OH)2]=1.6×10-14,故无Ni(OH)2沉淀产生。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
(2)白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a.量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b.将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c.取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d.重复滴定实验3次并记录数据。
e.计算白醋样品中醋酸总酸度。回答下列问题:
①实验a中量取20.00 mL白醋所用的仪器名称是_____________________。
②若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____________(填“偏大”、“偏小”或“不变”)。
③实验C中判断滴定终点的现象是________________________________。
④实验数据如下表,则该白醋样品中醋酸总酸度为________________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |