题目内容
【题目】PET是目前世界上产量最大的聚酯类合成纤维,冬奥会比赛场馆装饰材料、矿泉水瓶、磁带和胶卷的片基等都广泛采用PET材料。以卤代烃为原料合成PET的线路如下(反应中部分无机反应物及产物已省略)。已知RX2(R、R1代表烃基,X代表卤素原子)是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%。
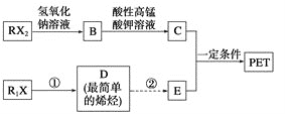
(1)RX2中苯环上有两个取代基,且苯环上的一硝基取代物只有一种。则RX2的结构简式为____________。
(2)1 mol C与足量碳酸氢钠溶液反应可放出________L CO2(标准状况下)。
(3)反应①的化学方程式为______________,其反应类型为________。从D到E,工业上一般通过两步反应来完成。若此处从原子利用率为100%的角度考虑,由D与某种无机物一步合成E,该无机物的化学式为________________。
(4)C的同分异构体M具有:①M分子中,苯环上有三个取代基;②与氯化铁溶液发生显色反应;③与新制氢氧化铜悬浊液在加热条件下反应;④在稀硫酸中能发生水解反应。同时符合上述条件的M的结构有________种。
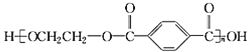
(5)写出合成PET的化学方程式:__________。
【答案】![]() 44.8 CH3CH2Cl+NaOH
44.8 CH3CH2Cl+NaOH![]() CH2=CH2↑+NaCl+H2O 消去反应 H2O2 10 n
CH2=CH2↑+NaCl+H2O 消去反应 H2O2 10 n![]() +nHOCH2CH2OH
+nHOCH2CH2OH![]()
 +(2n-1)H2O
+(2n-1)H2O
【解析】
RX2是芳香族化合物,相对分子质量为175,其中X元素的质量分数为40.6%,则X的相对原子质量为35.5,则X为Cl,RX2中为烃基的式量为104,RX2是芳香族化合物,利用商余法可知,RX2中含有碳原子数为8,氢原子数为8,所以RX2的分子式为C8H8Cl2,RX2苯环上只有两个取代基,且苯环上的一硝基取代物只有一种,则RX2的结构简式为![]() ,碱性水解得B为
,碱性水解得B为![]() ,B发生氧化反应生成C为
,B发生氧化反应生成C为![]() ,D是最简单的烯烃,则D为乙烯,结构简式为CH2=CH2,所以R1X为CH3CH2Cl,CH3CH2Cl发生消去反应生成乙烯,因为PET中高分子聚合物,结合C的结构可知,E应为HOCH2CH2OH,从原子利用率为100%的角度考虑,假设通过D与某种无机物一步合成E,则该无机物为H2O2,据此答题。
,D是最简单的烯烃,则D为乙烯,结构简式为CH2=CH2,所以R1X为CH3CH2Cl,CH3CH2Cl发生消去反应生成乙烯,因为PET中高分子聚合物,结合C的结构可知,E应为HOCH2CH2OH,从原子利用率为100%的角度考虑,假设通过D与某种无机物一步合成E,则该无机物为H2O2,据此答题。
根据上述分析可知RX2为![]() ,B为
,B为![]() ,C为
,C为![]() ,R1X为CH3CH2Cl,D为CH2=CH2,E为HOCH2CH2OH, PET为
,R1X为CH3CH2Cl,D为CH2=CH2,E为HOCH2CH2OH, PET为 。
。
(1)根据上面的分析可知,RX2的结构简式为![]() ;
;
(2)C为![]() ,分子中含有2个-COOH,由于酸性:羧酸>H2CO3,所以1 mol C与足量的NaHCO3溶液反应可放出2 mol CO2气体,在标准状况下其体积V(CO2)=2 mol×22.4 L/mol=44.8 L;
,分子中含有2个-COOH,由于酸性:羧酸>H2CO3,所以1 mol C与足量的NaHCO3溶液反应可放出2 mol CO2气体,在标准状况下其体积V(CO2)=2 mol×22.4 L/mol=44.8 L;
(3)反应①是CH3CH2Cl与NaOH的乙醇溶液在加热条件下发生消去反应产生CH2=CH2、HCl,反应方程式为:CH3CH2Cl+NaOH![]() CH2=CH2↑+NaCl+H2O,该反应为消去反应;D为CH2=CH2,E为HOCH2CH2OH,若此处从原子利用率为100%的角度考虑,由D与某种无机物一步合成E,该无机物的化学式H2O2;
CH2=CH2↑+NaCl+H2O,该反应为消去反应;D为CH2=CH2,E为HOCH2CH2OH,若此处从原子利用率为100%的角度考虑,由D与某种无机物一步合成E,该无机物的化学式H2O2;
(4) C为![]() ,C的同分异构体M具有:①M分子中,苯环上有三个取代基;②与氯化铁溶液发生显色反应,说明含有酚-OH;③与新制氢氧化铜悬浊液在加热条件下反应,说明含有醛基-CHO;④在稀硫酸中能发生水解反应,说明含有酯基。同时符合上述条件可能的官能团为:HCOO-、-OH、-CHO,三个官能团在苯环上处于邻位有3种不同结构;两种官能团处于邻位,另一个处于间位有2×3=6种;三个官能团都处于间位只有1种结构,所以符合条件的M的可能的同分异构体的结构有3+6+1=10种;
,C的同分异构体M具有:①M分子中,苯环上有三个取代基;②与氯化铁溶液发生显色反应,说明含有酚-OH;③与新制氢氧化铜悬浊液在加热条件下反应,说明含有醛基-CHO;④在稀硫酸中能发生水解反应,说明含有酯基。同时符合上述条件可能的官能团为:HCOO-、-OH、-CHO,三个官能团在苯环上处于邻位有3种不同结构;两种官能团处于邻位,另一个处于间位有2×3=6种;三个官能团都处于间位只有1种结构,所以符合条件的M的可能的同分异构体的结构有3+6+1=10种;
(4)C为![]() ,E为HOCH2CH2OH,二者在一定条件下通过缩聚反应生成高分子化合物PET的化学方程式为n
,E为HOCH2CH2OH,二者在一定条件下通过缩聚反应生成高分子化合物PET的化学方程式为n![]() +nHOCH2CH2OH
+nHOCH2CH2OH![]()
 +(2n-1)H2O。
+(2n-1)H2O。