��Ŀ����
����Ŀ��NaCl��NaClO�����������¿ɷ�����Ӧ��ClO-��Cl-��2H+=Cl2����H2O��ijѧϰС�����о�����Һ(��Ҫ�ɷ�ΪNaCl��NaClO)�ı��������
(1)������Һ��NaClO�����տ����е�CO2����NaHCO3��HClO��д����ѧ��Ӧ����ʽ___��
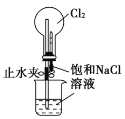
(2)ȡ��������Һ�����Թ��У���������һ��Ũ�ȵ����ᣬ������ų���ͨ������װ�ü�������ijɷֿ����ж�����Һ�Ƿ���ʡ�
��ѡ�Լ���98%Ũ���ᡢ1%Ʒ����Һ��1.0mol��L-1KI������Һ��1.0mol��L-1NaOH��Һ������ʯ��ˮ������NaCl��Һ��
���������ʵ�鷽����
�����Լ� | Ԥ������ͽ��� |
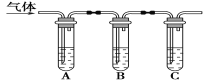
�Թ�A�м�������___�� �Թ�B�м�1%Ʒ����Һ�� �Թ�C�мӢ�___�� | ��A����Һ����ɫ��B����Һ����ɫ��C����Һ����ǣ�������Һ���ֱ��ʣ���___��������Һδ���ʣ���___��������Һ��ȫ���ʡ� |
���𰸡�NaClO+CO2+H2O=NaHCO3+HClO 1.0mol/LKI-������Һ ����ʯ��ˮ ��A�б���ɫ��B�в���ɫ��C�в������ ��A�в�����ɫ��B�в���ɫ��C�б����
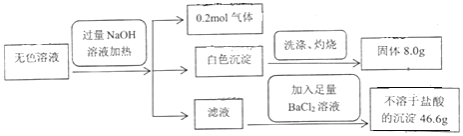
��������
(1)���ݴ��������������̼��ˮ��Ӧ����̼���������������д����ʽ��
(2)��������Һ�����ᷴӦ���ɵ��������Ƿ���������������̼�������ж�����Һ�ı����������������������1.0mol/L��KI-������Һ�����������̼�ù�����ʯ��ˮ�����ʵ����������жϡ�
(1)̼������Աȴ�����ǿ�����������������̼��ˮ��Ӧ����̼������������ᣬ��Ӧ�Ļ�ѧ����ʽΪNaClO+CO2+H2O=NaHCO3+HClO���ʴ�Ϊ��NaClO+CO2+H2O=NaHCO3+HClO��
(2)��������Һ�����ᷴӦ���ɵ��������Ƿ���������������̼�������ж�����Һ�ı��������װ��A�����Ǽ���������������1.0mol/L��KI-������Һ���飻װ��B�����Ǽ��������Ƿ������װ��C�Ǽ��������̼�������ó���ʯ��ˮ���飻��A����Һ����ɫ��B����Һ����ɫ��C����Һ����ǣ�������Һ���ֱ��ʣ���A����Һ����ɫ��B����Һ����ɫ(�ޱ仯)��C����Һ�������(�ޱ仯)��������Һδ���ʣ���A����Һ������ɫ(�ޱ仯)��B����Һ����ɫ(�ޱ仯)��C����Һ�����������Һ��ȫ���ʣ��ʴ�Ϊ��1.0mol/LKI-������Һ������ʯ��ˮ����A����Һ����ɫ��B����Һ����ɫ(�ޱ仯)��C����Һ�������(�ޱ仯)����A����Һ������ɫ(�ޱ仯)��B����Һ����ɫ(�ޱ仯) ��C����Һ����ǡ�

 �Ķ��쳵ϵ�д�
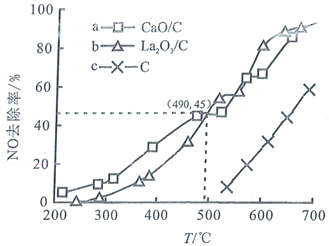
�Ķ��쳵ϵ�д�����Ŀ���û���̿��ԭ�����Դ����������ij�о�С����2L�ܱ������м���һ�����Ļ���̿��NO��������ӦC(s)��2NO(g) ![]() N2(g)��CO2(g) ��H��0����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ��(mol/L)�����ʾ��������˵������ȷ����
N2(g)��CO2(g) ��H��0����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ��(mol/L)�����ʾ��������˵������ȷ����
ʱ��/t(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
A. 10~20 min�ڣ�NO��ƽ����Ӧ����Ϊ0.018mol/��Lmin��
B. T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=0.25
C. ������ǰ30min�ķ�Ӧ������ͬ�����������м���2molN2��2molNO����ƽ�������ƶ�
D. 30min��ֻ�ı���һ���������������������жϣ�����������Ϊ��С�������
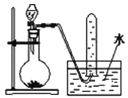
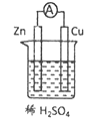
����Ŀ����������װ�û��������ʵ�飬���ܴﵽĿ�ĵ��ǣ� ��
|
|
|
���ڹ����� |
A.��ϡ������Cu��Ӧ��ȡNO | B.��֤������ԭ��Ӧ���е���ת�� | C.������Ȫʵ�� | D.��֤����������ܷ�����Ӧ |
A.AB.BC.CD.D