题目内容
4.A、B、C、D四种元素的原子序数均小于18,其最高正化合价依次为1、4、5、7.已知:B的原子核外次外层电子数为2;C、A的原子核外次外层电子数均为8;D元素的最高价氧化物的水化物在同一周期元素中酸性最强.则:(1)A、B分别是:ANa,BC.(填元素符号)
(2)D的离子结构示意图为
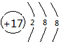 .
.(3)B的最高价氧化物与A的最高价氧化物的水化物反应可生成2种盐.
分析 已知B的原子核外次外层电子数为2,则B含有2个电子层,根据其最高正价为4可知B为C元素;
A、C原子的核外次外层电子数为8,原子序数都小于18,且最高正价分别为1、5,则A为Na元素、C为P元素;
D元素的最高价氧化物对应的水化物是已知含氧酸中最强的酸,该酸为高氯酸,且满足Cl的最高价为+7,所以D为Cl元素,
根据以上分析并结合元素周期律知识进行解答.
解答 解:已知B的原子核外次外层电子数为2,则B含有2个电子层,根据其最高正价为4可知B为C元素;A、C原子的核外次外层电子数为8,原子序数都小于18,且最高正价分别为1、5,则A为Na元素、C为P元素;D元素的最高价氧化物对应的水化物是已知含氧酸中最强的酸,该酸为高氯酸,且满足Cl的最高价为+7,所以D为Cl元素,
(1)根据分析可知,A为Na元素、B为C元素,
故答案为:Na;C;
(2)D为Cl元素,氯离子的核电荷数为17,核外电子总数为18,最外层为8个电子,其离子结构示意图为: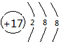 ,
,
故答案为: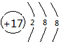 ;
;
(3)B的最高价氧化物为二氧化碳,A的最高价氧化物的水化物为NaOH,当二氧化碳不足时,反应生成碳酸钠,当二氧化碳过量时,反应生成碳酸氢钠,所以二者可以生成2种盐,
故答案为:2.
点评 本题考查了位置、结构与性质关系的应用,题目难度不大,推断各元素名称为解答关键,注意掌握元素周期表结构、元素周期律的内容,明确常见化学用语的书写原则,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
17.常温下,一元酸HA溶液和NaOH溶液等体积混合(忽略体积变化),实验数据如下表下列判断正确的是( )
| 实验编号 | 起始浓度/mol•L-1 | 反应后溶液的pH | |
| c(HA) | c(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | X | 0.2 | 7 |
| ③ | 0.2 | 0.1 | 4.8 |
| ④ | 0.1 | 0.2 | y |
| A. | 实验①反应后的溶液中:c(HA)约为$\frac{{K}_{W}}{1×1{0}^{-9}}$mol•L-1 | |
| B. | 实验②反应后的溶液中:c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| C. | 实验③反应后的溶液中:c(HA)+c(H+)=c(OH-)+c(A-) | |
| D. | 实验④反应后的溶液中:c(OH-)-c(H+)-c(HA)=0.05mol•L-1 |
18.W、X、Y、Z四种元素是原子序数依次增大的短周期主族元素,已知:①四种元素的电子层数之和等于10,且它们是连续的四种主族元素;②四种元素的原子,其半径最大的是X原子.下列说法正确的是( )
| A. | W和X均位于第二周期 | B. | Y和Z分别是Al和Si | ||
| C. | W和X分别是O和F | D. | Z的金属性可能比X强 |
19.1999年曾报道合成和分离了含高能量的N5+的化合物N5AsF6,下列叙述错误的是( )
| A. | N5+中氮-氮之间是以共价键结合 | B. | N5+具有35个电子 | ||
| C. | 化合物N5AsF6中As的化合价为+5 | D. | 化合物N5AsF6中F的化合价为-1 |
9.能使酸性高锰酸钾溶液褪色而不能使溴水褪色的烃是( )
| A. | CH2=CH-CH2-CH2-CH2-CH3 | B. | HC≡C-CH2-CH2-CH2-CH3 | ||
| C. |  | D. | 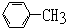 |
16.已知XO32-有42个电子,有关X原子的描述正确的是( )
| A. | X原子核外有16个电子 | |
| B. | XO32-有42个质子 | |
| C. | X的氧化物对应的水化物是一种强酸 | |
| D. | X为金属元素 |
13.某化合物6.2g在O2中完全燃烧,只生成8.8g CO2和5.4g H2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:2 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
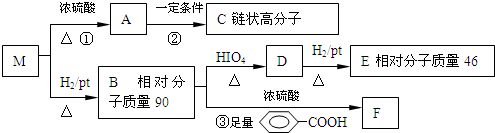
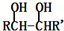 $→_{△}^{HIO_{4}}$RCHO+OHR′
$→_{△}^{HIO_{4}}$RCHO+OHR′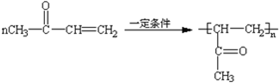 ;
;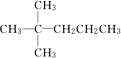 ,并对其命名2,2-二甲基戊烷.其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.
,并对其命名2,2-二甲基戊烷.其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.