题目内容
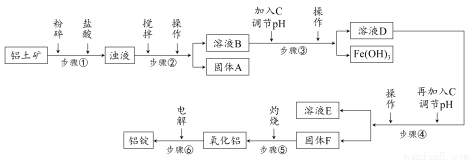
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
一些氢氧化物沉淀的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
完全沉淀pH(离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。
(1)Al2O3+6H+=2Al3++3H2O (2)过滤 (3)SiO2 NaOH[或Ca(OH)2] ④ (4)4.1<pH<4.5(或略大于4.1,损失一点儿Al3+,保证Fe3+沉淀完全) 5.2<pH<10.4(或6<pH<10) (5)2Al2O3(熔融)  4Al+3O2↑
4Al+3O2↑
【解析】②③④的操作均是分离固体和液体,该操作应是过滤;SiO2不与盐酸发生反应,固体A为SiO2;加入C调节pH值,中和盐酸,并控制氢氧化物沉淀的pH;保证Fe3+沉淀完全,分析表格数据,步骤③应控制在4.1<pH<4.5,步骤④应控制在5.2<pH<10.4(或6<pH<10);控制范围决定了Na+、Ca2+、Mg2+是在步骤④中除去的;步骤⑥为工业上电解氧化铝。

 阅读快车系列答案
阅读快车系列答案某兴趣小组为探究外界条件对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
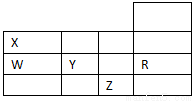
| A | B | C |
Ⅰ | 0.050 mol·L-1 | 0.050 mol·L-1 | 0.050 mol·L-1 |
Ⅱ | 0.070 mol·L-1 | 0.070 mol·L-1 | 0.098 mol·L-1 |
Ⅲ | 0.060 mol·L-1 | 0.060 mol·L-1 | 0.040 mol·L-1 |
Ⅳ | 0.080 mol·L-1 | 0.080 mol·L-1 | 0.12 mol·L-1 |
针对上述系列试验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20 mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现