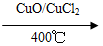题目内容
短周期元素A、B、C的原子序数依次增大。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是( )
A.原子半径:A<B<C
B.A单质的氧化性小于C单质
C.B的硫酸盐溶液pH<7
D.B元素单质可溶于酸但不溶于碱
C
【解析】设A的最外层电子数为x,则B、C的最外层电子数分别为0.5x、x,根据题意有等式:x+0.5x+x=15;解得x=6,则A、C对应的元素分别为O、S,介于O、S之间的最外层电子数为3的元素为Al。原子半径:O<S<Al,A错;A的单质为氧气和臭氧,其氧化性比硫单质的氧化性强,B错;Al2(SO4)3是强酸弱碱盐,其水溶液显酸性,pH<7,C正确;B元素所形成的单质金属铝既能与酸反应,又能与强碱反应,D错。

醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:
反应 | 乙醇(mol) | 乙酸(mol) | 乙酸乙酯(mol) |
1 | 2 | 2 | 1.33 |
2 | 3 | 2 | 1.57 |
3 | 4 | 2 | x |
4 | 5 | 2 | 1.76 |
由表中数据推测,数值x的范围是________。
(2)现有25°C时,pH=3的醋酸。请回答以下问题:
①若向醋酸中加入少量醋酸钠固体,此时溶液中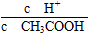 将________(填“增大”“减小”或“不变”);
将________(填“增大”“减小”或“不变”);
②若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH________7(填“>”“<”或“=”);
③若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是________。
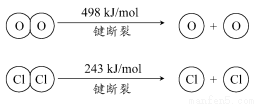
中华商务网讯:2011年中国将超北美成为全球液晶显示器第二大市场。生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/(kJ·mol-1) | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)→2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
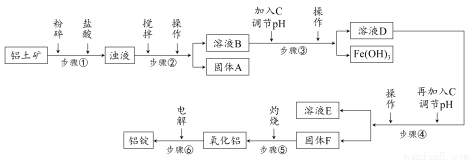
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
一些氢氧化物沉淀的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
完全沉淀pH(离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。