题目内容
下列有关铁元素的叙述中正确的是( )
A.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:
Fe(OH)2<Fe(OH)3
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D.铁元素位于周期表的第四周期第ⅧB族
A
【解析】I2的氧化性较弱,铁与I2反应生成FeI2,B错;氢氧化铁与氢碘酸发生氧化还原反应:2Fe(OH)3+6HI=2FeI2+I2+6H2O,C错;铁元素位于周期表的第四周期第Ⅷ族,D错。

中华商务网讯:2011年中国将超北美成为全球液晶显示器第二大市场。生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/(kJ·mol-1) | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)→2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下:
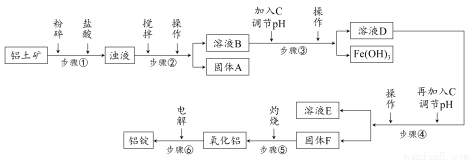
一些氢氧化物沉淀的pH如下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
开始沉淀pH(离子初始浓度0.01 mol/L) | 4 | 2.3 | 10.4 |
完全沉淀pH(离子浓度<10-5 mol/L) | 5.2 | 4.1 | 12.4 |
请回答下列问题:
(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。