题目内容
8.I.碱性锌锰干电池的总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2.该电池中,负极材料是Zn,正极反应式为MnO2+e-+H2O=MnOOH+OH-.Ⅱ.以废旧锌锰干电池处理得到的混合物为原料制备锰锌铁氧体的主要流程如图1所示.
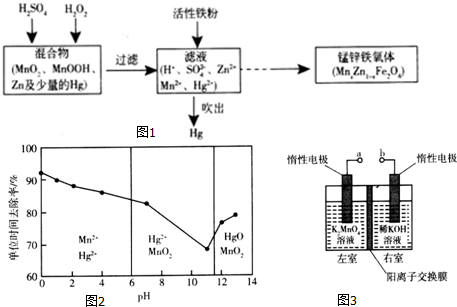
请回答下列问题:
(1)MnxZn1-xFe2O4中铁元素化合价为+3,则锰元素的化合价为+2.
(2)活性铁粉除汞时,铁粉的作用是还原剂(填“氧化剂”或“还原剂”).
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的.在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如图2所示.
①写出pH=2时KMnO4溶液吸收汞蒸气的离子方程式5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O.
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4溶液的氧化性增强外,还可能是Mn2+具有催化作用.
(4)用惰性电极电解K2MnO4溶液制备KMnO4的装置如图3所示.
①a应接直流电源的正(填“正”或“负”)极.
②已知25℃,两室溶液的体积均为100mL,电解一段时间后,右室溶液的pH由10变为14,则理论上可制得0.1mol KMnO4 (忽略溶液的体积和温度变化).
分析 Ⅰ、碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,正极MnO2得电子被还原生成MnOOH,反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-;
Ⅱ、(1)在MnxZn1-xFe2O4中,Fe是+3价,O是-2价,Mn和Zn相当于1个原子;
(2)利用铁粉把Hg还原出来;
(3)①酸性高锰酸钾具有强氧化性,能够将Hg氧化;
②从影响化学反应速率的外界因素分析;
(4)电解K2MnO4制取KMnO4,阴极上水得电子发生还原反应生成氢气和氢氧根离子,阳极上锰酸根离子失电子反应氧化反应生成高锰酸根离子,据此分析.
解答 解:Ⅰ、碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,Zn为负极,Zn失电子生成锌离子,正极MnO2得电子被还原生成MnOOH,反应式为MnO2+H2O+e-═MnOOH+OH-,
故答案为:Zn;MnO2+e-+H2O=MnOOH+OH-;
Ⅱ、(1)在MnxZn1-xFe2O4中,Fe是+3价,O是-2价,Mn和Zn相当于1个原子,任何化合物中元素化合价代数和为0,所以Mn和Zn都是+2价,故答案为:+2;
(2)铁粉具有还原性,能把汞离子还原为汞单质,所以铁粉的作用是还原剂,故答案为:还原剂;
(3)①酸性高锰酸钾能够将Hg氧化为汞离子,本身被还原为锰离子,Mn化合价从+7降为+2价,Hg从0价升至+2价,其物质的量之比为5:2,结合原子守恒配平方程式为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O,故答案为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;
②反应过程中,反应物浓度降低、温度不变、溶液中压强无影响,反应速率加快,只能是生成的Mn2+具有催化作用,故答案为:Mn2+具有催化作用;
(4)①阳极上锰酸根离子失电子反应氧化反应生成高锰酸根离子,所以a为正极,故答案为:正;
②据电极反应式2H2O+2e-=H2↑+2OH-可知,两室溶液的体积均为100mL,电解一段时间后,右室溶液的pH由10变为14,生成n(OH-)=1mol/L×0.1L=0.1mol,总反应方程式为2MnO42-+2H2O=2MnO4-+H2↑+2OH-,所以生成MnO42-物质的量为0.1mol,故答案为:0.1.
点评 本题考查了原电池原理、氧化还原反应的计算以及氧化还原反应方程式书写、影响反应速率的因素、电解池,题目难度较大.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | NH4+ Na+ OH- | B. | Na+ H+ SO32- | ||
| C. | K+ NO3- Cl- | D. | Ca2+ NO3- CO32- |
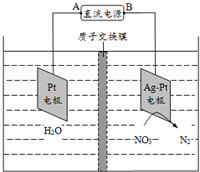
| A. | 电源的正极为b | |
| B. | 电解时H+从膜右侧迁移到膜左侧 | |
| C. | Ag-Pt电极反应为:2H2O-4e-=4H++O2↑ | |
| D. | 若转移的电子数为1.204×1024,生成N25.6 g |
| A. | 浓盐酸 | B. | 浓硫酸 | C. | 食盐 | D. | 氢氧化钠 |
| A. | 物质失电子的反应为氧化反应 | |
| B. | 物质在变化中失去了电子,此物质是氧化剂 | |
| C. | 发生电子转移的反应即是氧化还原反应 | |
| D. | 发生化合价升降的反应不一定是氧化还原反应 |
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VⅠA | VⅡA |
| 2 | a | b | c | ||||
| 3 | d | e | f | g | h | i |
| A. | a、b、e、f四种元素的原子半径:e>f>b>a | |
| B. | h、i两种元素阴离子的还原性:h>i | |
| C. | a、g两种元素氢化物的稳定性:g>a | |
| D. | d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强 |
| A. | 原子是化学变化中的最小微粒 | |
| B. | 分子是化学变化中的最小微粒 | |
| C. | 原子是可分成更小粒子的实心球 | |
| D. | 原子是构成一切物质的基本粒子,是构成物质的最小粒子 |
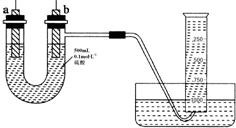 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气. .从分液漏斗上口倒出的上层液体是苯.
.从分液漏斗上口倒出的上层液体是苯.