题目内容
19.镭是元素周期表中第七周期第ⅡA族元素,关于其叙述不正确的是( )| A. | 镭的金属性比钙弱 | B. | 单质能与水反应生成氢气 | ||
| C. | 在化合物中呈+2价 | D. | 碳酸镭难溶于水 |
分析 A.同主族自上而下金属性增强;
B.镭的金属性比Ca、Ba等强,能与水发生剧烈反应生成氢气;
C.镭是周期表第7周期ⅡA族的元素,最外层有2个电子,其化合价等于最外层电子数;
D.同主族元素化合物性质相似,根据碳酸镁、碳酸钙的溶解性进行判断.
解答 解:A.同主族元素从上到下元素的金属性逐渐增强,则镭的金属性比钙强,故A错误;
B.镭的金属性比Ca、Ba等强,能与水发生剧烈反应,放出氢气,故B正确;
C.镭是周期表第7周期ⅡA族的元素,最外层有2个电子,则在化合物中呈现+2价,故C正确;
D.已知碳酸镁、碳酸钙难溶于水,根据同主族元素对应单质、化合物的性质的相似性可知,镭的碳酸盐难溶于水,故D正确,
故选:A.
点评 本题考查元素周期表与周期律的综合应用,题目难度不大,注意根据周期律的递变规律推断元素可能具有的性质.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
10.下列实验不能作为判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 |
7.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的试验组别是( )
| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 铁的状态 | 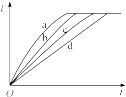 |
| 1 | 2.0 | 25 | 块状 | |
| 2 | 2.5 | 30 | 块状 | |
| 3 | 2.5 | 50 | 粉末状 | |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-2-1 | B. | 1-2-4-3 | C. | 4-3-2-1 | D. | 1-2-3-4 |
14.下列说法正确的是( )
| A. | 按系统命名法,有机物 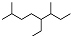 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为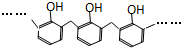 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 |
4.下列有关核外电子的运动状态的说法中错误的是( )
| A. | 电子亚层(能级)是描述电子运动的电子云状态 | |
| B. | 只有在电子层、电子亚层、电子云的伸展方向及电子的自旋都确定时,电子的运动状态才能确定下来 | |
| C. | 必须在B项所述四个方面都确定时,才能决定组成每一能层的最多轨道数 | |
| D. | 电子云伸展方向与能量大小是无关的 |
11.某反应的反应过程中能量变化如图所示.下列有关叙述正确的是( )
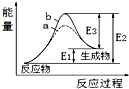

| A. | 该反应为放热反应 | |
| B. | b表示的有催化剂 | |
| C. | 催化剂能降低正、逆反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
8.下列反应所得溶液中,一定只含一种溶质的是( )
| A. | 向氯化铝溶液中加入过量的氨水 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向稀硝酸中加入铁粉 | |
| D. | 向硫酸酸化的MgSO4溶液中加入过量的Ba(OH)2溶液 |
9.短周期元素X、Y、Z、W的原子序数依次增大,X-与Y2+电子层结构与Ne原子的电子层结构相同,Z单质是金属,W的最外层电子数是内层电子总数的一半,下列正确的是( )
| A. | 原子半径r(X)<r(Y),离子半径r(X-)>r(Y2+) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Z是活泼的金属,其最高价氧化物对应的水合物为强碱 |