题目内容
【题目】金属钠与水的反应是中学化学中的一个重要反应。高一化学教材中该实验曾出现过几种不同的演示方法。分别如下图中(A)(B)(C)所示:
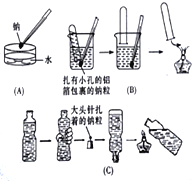
(1)现按图(A)所示的方法,在室温时,向盛有饱和Na2CO3溶液(滴有几滴酚酞)的烧杯中,加入一小块金属钠。
①下列现象描述正确的是_______(填字母代号)。
A.钠浮在液面上,并四处游动,最后消失 B.反应过程中钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色 D.恢复到室温时,烧杯底部有固体物质析出
②请补充并完成该实验从试剂瓶中取出钠到向烧杯中投入钠的有关操作:
用镊子从试剂瓶中取出一小块钠→_______________→用镊子夹取切好的金属钠投入到盛有饱和Na2CO3溶液的烧杯中。
(2)按图(C)所示的方法进行该实验,若500mL的矿泉水瓶开始时装有477.6mL水,要使倒置的矿泉水瓶正好恢复原状,假设矿泉水瓶内外均为标准状况,则大头针上扎着的钠粒质量为_______g。
(3)1998年全国高考试题中的实验题就是根据图(B)的原理设计的。题目及部分答案如下:
测定一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800毫升烧杯、100毫升量筒、短颈玻璃漏斗、长颈漏斗、玻璃棒、铜网、铝锌合金样品、浓盐酸(密度1.19克/毫升)、水。按图示装置进行实验,回答下列问题。(设合金样品完全反应,产生的气体体积不超过100毫升)
Ⅰ.补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800毫升烧杯底部,把短颈漏斗倒扣在样品上面。……
[答案]
Ⅰ.②往烧杯中注入水,直至水面没过漏斗颈。[评分标准,凡加水改为加酸者,不论其他后续步骤是否正确,本小题一律0分]
③在100毫升量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈插入量筒中。烧杯中水面到杯口至少保留约100毫升空间。
④将“仅器A”插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生。
回答下列问题:
a.为什么在“②往烧杯中注入水,直至水面没过调斗颈”这一步中改加水为加酸会得0分:______________________________________________________________________________。
b.“仪器A”可以是________________________。
c.合金样品用铜网包裹的目的是____________________________________。
【答案】 ABD 用滤纸吸干表面的煤油,在玻璃片上用小刀切下一颗绿豆大小的表面无氧化物的钠粒,并将多余的钠放回试剂瓶中(关键词:“吸”“切”“放回”) 0.046 ①先加酸会导致有部分H2 逸出而无法收集,影响测定准确度;②不安全或实验者没有自我保护意识(因将盛水的量筒倒插入烧杯中时,手会与烧杯中的酸接触);③酸的用量太大,浪费试剂( 关键词:“准确”“安全”节约”) 长颈漏斗(或答玻璃棒) 使样品在反应时能保持在烧杯底适当的位置(或答避免反应时样品漂浮,即起镊子夹持的作用)
【解析】(1)①将钠放入盐溶液中,钠直接和水反应生成NaOH和氢气,呈现的现象是:钠浮在水面上,熔化成一个光亮的小球,四处游动,最后消失。钠与水反应消耗水,饱和Na2CO3溶液中有Na2CO3晶体析出。故答案为:ABD;
②做钠和水的反应实验时,用滤纸吸干表面的煤油,在玻璃片上用小刀切成绿豆大小的钠粒,并将多余的钠放回试剂瓶中。
(2)500mL的矿泉水瓶装有477.6mL水,则有500-477.6=22.4mL的空气被挤出瓶子,使得瓶子变瘪,若要使瓶子复原,需要22.4mL氢气,使瓶子膨胀。设消耗的钠的质量是x,则有:
2Na + 2H2O ═ 2NaOH + H2↑
2×23g22400mL
x 224mL
解得,x=0.046g,即大头针上扎着的钠粒质量为0.046g。
故答案为:0.046;
(3)实验思路分析:向一定质量的合金中加强酸,反应生成氢气;用排水法量气体的体积,量筒中装满水,产生的氢气将水排出,排出水的体积等于氢气的体积。
实验步骤分析:第①步,将一定质量的合金放置于烧杯中,把短颈漏斗倒扣在样品上面,这样就组成了一个简易的发生装置,可以让合金与酸在漏斗中反应;第②步,向漏斗中加水,浸没漏斗颈,此时水液面要比较高,否则,后面量筒中的水会直接流入烧杯。这一步中不能够加酸,否则金属会马上与酸反应。因为收集装置还没有安装好,无法收集并准确测量产生的气体的体积;并且在进行后续操作“将盛水的量筒倒插入烧杯中”时,手会与烧杯中的酸接触时手会受到腐蚀;从药品用量的角度来看,需要大量的酸,才能浸没漏斗颈。第③步,将装满水的100mL量筒倒置于盛水的烧杯中,装置组装完成。第④步,加酸,合金开始反应。
a、为什么在“②往烧杯中注入水,直至水面没过调斗颈”这一步中改加水为加酸会得0分:根据上述步骤分析,可以从三个方面来解答,“准确性”、“安全性”、“节约型”。
故答案为:①先加酸会导致有部分H2逸出而无法收集,影响测定准确度;②不安全或实验者没有自我保护意识;③酸的用量太大,浪费试剂。
b、装置组装完成后,可以将长颈漏斗插入烧杯并接近烧杯底部(靠近漏斗),通过它慢慢加入盐酸,至有气体产生;也可以使用玻璃棒引流。
故答案为:长颈漏斗或玻璃棒;
c、由于金属是铝锌合金,密度较小,在跟盐酸反应时可以上下浮动,铝屑或铝片易顺着漏斗漂浮而出,给实验结果造成相当大的误差,所以用不与盐酸反应的铜网包裹,可以使样品在反应时能保持在烧杯底部的位置,使之不致漂浮,起到了镊子夹持的作用。


