题目内容
5. 碳酸氢铵是一种重要的铵盐.实验室中,将二氧化碳通入氨水可制得碳酸氢铵.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.完成下列填空:
碳酸氢铵是一种重要的铵盐.实验室中,将二氧化碳通入氨水可制得碳酸氢铵.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.完成下列填空:(1)写出上述制备小苏打的化学方程式.NH4HCO3+NaCl=NaHCO3↓+NH4Cl
请你再设计出一种实验室制取少量碳酸氢钠的方法.可采用烧碱溶液中通入过量CO2或往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠
(2)含0.900mol NH3的水溶液质量为60.0g,向该溶液通入二氧化碳至反应完全,过滤,得到滤液32.8g,则NH4HCO3的产率为94%.
(3)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是bc.(选填编号)
a.①的滤液可直接循环使用 b.①析出的氯化铵纯度更高
c.②的滤液可直接循环使用 d.②析出的氯化铵纯度更高
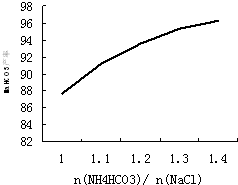
(4)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,如图是$\frac{n(N{H}_{4}HC{O}_{3})}{n({N}_{a}Cl)}$(摩尔比)对NaHCO3产率的影响.实际生产中选择$\frac{n(N{H}_{4}HC{O}_{3})}{n({N}_{a}Cl)}$=1.2.
①下列相关说法正确的是bc.
a.碳酸氢铵过量是为了充分利用饱和食盐水
b.碳酸氢铵过量是为了减少纯碱中的NaCl
c.碳酸氢铵过量太多将会导致生产成本过高
②不考虑生产过程中的损耗,生产1mol纯碱,
需消耗碳酸氢铵2.4mol.
(5)称取1.840g小苏打样品(含少量NaCl),配置成250mL溶液,取出25.00mL用0.1000mol/L盐酸滴定,消耗盐酸21.50mL.实验中所需要的定量仪器除滴定管外,还有电子天平、250mL容量瓶.选用甲基橙而不选酚酞作为指示剂的原因是使用甲基橙易判断滴定终点,误差小.样品中NaHCO3质量分数为0.982.(保留3位小数)
分析 (1)饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),根据质量守恒可知同时生成NH4Cl;烧碱或碳酸钠和过量二氧化碳反应生成碳酸氢钠;
(2)根据碳原子守恒计算理论上m(NH4HCO3),根据题意计算实际m(NH4HCO3),从而计算其产率;
(3)母液中含有氯化铵,通入氨,冷却、加食盐,有利于氯化铵的析出,过滤后滤液中含有氨气,不能直接循环使用;
(4)①根据氯化钠过多会残留在NaHCO3,最终氯化钠混杂在纯碱中,酸氢铵过量太多将会导致生产成本过高;②根据题目信息以及化学方程式来计算;
(5)配制溶液需要容量瓶,固体称量需要天平;利用滴定终点和酚酞的变色范围分析;根据盐酸的物质的量可确定碳酸氢钠的质量,进而可计算质量分数.
解答 解:(1)饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),根据质量守恒可知同时生成NH4Cl,反应的方程式为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
可采用烧碱溶液中通入过量CO2或往饱和Na2CO3 溶液中通入过量CO2等得到碳酸氢钠,
故答案为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl;可采用烧碱溶液中通入过量CO2或往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠;
(2)该氨水完全反应需通入0.9molCO2,过滤得到m(NH4HCO3)=60.0g+0.90mol×44g•mol-1-32.8g=66.8g,根据碳原子守恒,理论上应得到m(NH4HCO3)=0.9mol×79g•mol-1=71.1g,则NH4HCO3的产率为$\frac{66.8g}{71.1g}$×100%=94%,
故答案为:94;
(3)母液中含有氯化铵,通入氨,冷却、加食盐,有利于氯化铵的析出,纯度更高,过滤后滤液中含有氨气,不能直接循环使用,而②的滤液可直接循环使用,
故答案为:bc;
(4)①氯化钠过多会残留在NaHCO3,最终氯化钠混杂在纯碱中;而碳酸氢铵过量太多将会导致生产成本过高,所以实际生产中选择$\frac{n(N{H}_{4}HC{O}_{3})}{n(NaCl)}$=1.2;
故答案为:bc;
②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑
2mol 1mol
NaCl+NH4HCO3=NaHCO3↓+NH4Cl
2mol 2mol
实际生产中选择$\frac{n(N{H}_{4}HC{O}_{3})}{n(NaCl)}$=1.2,所以n(NH4HCO3)=2.4mol;
故答案为:2.4;
(5)配成250ml碳酸氢钠溶液,用到的仪器有电子天平、烧杯、玻璃棒、250mL容量瓶、胶头滴管,所以所需的定量仪器还应该有电子天平、250mL容量瓶;
碳酸氢钠溶液的pH本来就接近8.2,与酚酞变色的pH接近,变色时的pH和反应终点的pH不好判断;而使用甲基橙容易判断终点,且反应产生的二氧化碳不能全部逸出使溶液偏酸性,因此使用甲基橙的误差小(使用甲基橙易判断滴定终点,误差小),
消耗盐酸的物质的量n(HCl)=0.0215L×0.1000mol/L=0.00215mol,则25mL溶液中n(NaHCO3)=0.00215mol,所以样品中m(NaHCO3)=0.00215mol×10×84g/mol=1.806g,ω(NaHCO3)=$\frac{1.806g}{1.84g}$×100%=98.2%=0.982,
故答案为:电子天平、250mL容量瓶;使用甲基橙易判断滴定终点,误差小;0.982.
点评 本题主要考查制备实验的设计,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验原理以及物质的性质,难度中等.

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案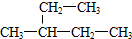 ,它的名称是( )
,它的名称是( )| A. | 3-乙基丁烷 | B. | 3-乙基戊烷 | C. | 2-乙基丁烷 | D. | 3-甲基戊烷 |
| A. | 冰雪融化 | B. | 干冰升华 | C. | 蜡烛燃烧 | D. | 酒精挥发 |
| A. | 熔融的氢氧化钠 | B. | 硝酸钾溶液 | C. | 硫酸铜晶体 | D. | 无水乙醇 |
| A. | 3S2-+2NO3-+8H+→2NO↑+3S↓+4H2O | |
| B. | S2-+2NO3-+4H+→2NO2↑+S↓+2H2O | |
| C. | Fe3++3NO3-+5H2S+2H+→3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++5NO3-+8H2S+4H+→5NO↑+8S↓+Fe2++10H2O |
| A. | 由反应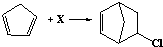 可知,X为氯乙烯 可知,X为氯乙烯 | |
| B. | 异辛烷的结构为(CH3)3CCH2CH(CH3)2,它的一氯代物共有4种同分异构体(不考虑对映异构体),且它们的熔点、沸点各不相同 | |
| C. | 已知CHCl3+HF→CHFCl2+HCl,此反应与由苯制备溴苯的反应类型相同 | |
| D. | 棉、毛、丝、麻完全燃烧时,都只生成CO2和H2O |
| A. | 铁 | B. | 铝 | C. | 镁 | D. | 铜 |
| A. | 反应中H2O作还原剂 | |
| B. | Na2O2 和Na2O2 均属于碱性氧化物 | |
| C. | Na2O2晶体中阴、阳离子个数之比为1:1 | |
| D. | 反应中Na2O2既发生氧化反应,又发生还原反应 |
