题目内容
2.按原子序数递增的顺序(稀有气体除外),对第三周期元素性质的描述正确的是( )| A. | 原子半径和离子半径均减小 | |
| B. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| C. | 非金属气态氢化物稳定性逐渐增强 | |
| D. | 单质的熔点降低 |
分析 A.一般来讲,电子层越多,粒子半径越大,电子层相同时核电荷数越大,粒子半径越小;
B.必须是最高价氧化物对应的水化物,不是最高价,不一定满足;
C.根据元素的非金属性越强气态氢化物稳定性越强来判断;
D.金属单质的熔点降低,而非金属单质中,原子晶体沸点大于金属晶体,分子晶体沸点较低
解答 解:A.第三周期中,随着原子序数的递增,原子半径逐渐减小,而离子半径需要根据阴阳离子进行讨论,阳离子只有2个电子层,随着核电荷数在增大,半径逐渐减小,而阴离子有3个电子层,随着核电荷数的增加逐渐减小,但是阴离子半径整体大于阳离子半径,故A错误;
B.必须指出是最高价氧化物对应的水化物的碱性减弱,酸性增强,否则不一定成立,故B错误;
C.第三周期中,随着原子序数的递增,原子半径逐渐减小,元素的非金属性增强,气态氢化物稳定性增强,故C正确;
D.金属单质的熔点降低,Si单质为原子晶体,则单质熔点大小为:Na<Mg<Al<Si(原子晶体),其它非金属单质P、S、Cl2为分子晶体,熔点比金属单质低,故整体趋势为:Si>Al>Mg>S>P>Na>Cl2,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确元素周期律的内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,B为易错点,注意必须是最高价氧化物对应的水化物.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.对于一定体积和条件下的可逆反应:N2+3H2?2NH3,能说明反应已达平衡状态的是( )
| A. | 百分组成 NH3%=N2% | B. | 气体的密度不变 | ||
| C. | 压强不变 | D. | c(H2):c(N2):c(NH3)=3:1:2 |
13.下列物质能够导电的是( )
| A. | 熔融的氢氧化钠 | B. | 硝酸钾溶液 | C. | 硫酸铜晶体 | D. | 无水乙醇 |
10.下列说法不正确的是( )
| A. | 由反应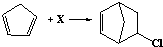 可知,X为氯乙烯 可知,X为氯乙烯 | |
| B. | 异辛烷的结构为(CH3)3CCH2CH(CH3)2,它的一氯代物共有4种同分异构体(不考虑对映异构体),且它们的熔点、沸点各不相同 | |
| C. | 已知CHCl3+HF→CHFCl2+HCl,此反应与由苯制备溴苯的反应类型相同 | |
| D. | 棉、毛、丝、麻完全燃烧时,都只生成CO2和H2O |
17.在常温下,遇浓硝酸发生钝化的轻金属是( )
| A. | 铁 | B. | 铝 | C. | 镁 | D. | 铜 |
7.某同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A. | 所用NaOH已经潮解 | |
| B. | 向容量瓶中加水定容时俯视标线 | |
| C. | 用量筒量取所需的浓盐酸时俯视刻度线 | |
| D. | 定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水 |
14.将Na2O2投入H2O中发生的反应为:2Na2O2+2H2O=4NaOH+O2↑.下列说法正确的是( )
| A. | 反应中H2O作还原剂 | |
| B. | Na2O2 和Na2O2 均属于碱性氧化物 | |
| C. | Na2O2晶体中阴、阳离子个数之比为1:1 | |
| D. | 反应中Na2O2既发生氧化反应,又发生还原反应 |
11.某物质可由两种单质直接化合生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生.下列物质中不符合上述条件的是( )
| A. | AlCl3 | B. | Na2O2 | C. | FeCl2 | D. | Al2S3 |
12.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 饱和氯水中Cl-、NO3-、Na+、SO32- | B. | 在碱性溶液中CO32-、K+、SO42-、Br- | ||
| C. | Na2S溶液中SO42-、K+、Cl-、Cu2+ | D. | pH=12的溶液中NO3-、I-、Na+、Al3+ |