题目内容
【题目】某无色混合物水溶液,可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Ba2+、Cl-、CO32-、SO42-。取100mL该溶液进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀盐酸,在标准状况下放出0.56 L气体(不考虑气体溶解);
II.向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;
试回答下列问题:
(1)肯定存在的离子有______________________________,肯定不存在的离子有___________________________________;
(2)可能存在的离子是__________________________________________________,判断该离子存在与否的方法是______________________________________________________________________________________________________________________________________;
(3)肯定存在的阳离子在原溶液中的物质的量浓度至少为_______________________________________________。
【答案】 CO32-、SO42-、K+ Mg2+、Fe3+、Ba2+ Cl— 取原溶液少许于试管中,滴加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀产生,说明有Cl-;反之,没有 c(K+)至少为0.7 mol/L
【解析】某无色混合物水溶液,含Fe3+的溶液呈棕黄色,则该水溶液中一定不含有Fe3+离子,向该溶液中加入足量稀盐酸,在标准状况下放出0.56 L气体,气体应该为二氧化碳,且物质的量为![]() =0.025mol,则溶液中一定含CO32-,且物质的量为0.025mol;碳酸镁微溶、碳酸钡难溶,CO32-与Mg2+、Ba2+不能大量共存,故溶液中一定不含Mg2+离子,向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;则应该还含有SO42-离子且物质的量为
=0.025mol,则溶液中一定含CO32-,且物质的量为0.025mol;碳酸镁微溶、碳酸钡难溶,CO32-与Mg2+、Ba2+不能大量共存,故溶液中一定不含Mg2+离子,向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33g;则应该还含有SO42-离子且物质的量为![]() =0.01mol,根据溶液电中性的原则,溶液中还应该有阳离子,而排除Mg2+、Fe3+、Ba2+以外,溶液中一定含有K+离子;综上所得:(1)肯定存在的离子有CO32-、SO42-、K+;肯定不存在的离子有Mg2+、Fe3+、Ba2+;题中没有涉及Cl—的检验,故(2)可能存在的离子是Cl—,判断该离子存在与否的方法是取原溶液少许于试管中,滴加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀产生,说明有Cl-;反之,没有;(3)CO32-物质的量为0.025mol;SO42-离子物质的量为0.01mol,根据电荷守恒,肯定存在的阳离子K+在原溶液中的物质的量至少为2×(0.025mol +0.01mol)=0.07mol,溶液的体积为100mL,则K+的浓度为:
=0.01mol,根据溶液电中性的原则,溶液中还应该有阳离子,而排除Mg2+、Fe3+、Ba2+以外,溶液中一定含有K+离子;综上所得:(1)肯定存在的离子有CO32-、SO42-、K+;肯定不存在的离子有Mg2+、Fe3+、Ba2+;题中没有涉及Cl—的检验,故(2)可能存在的离子是Cl—,判断该离子存在与否的方法是取原溶液少许于试管中,滴加过量Ba(NO3)2溶液,过滤后往滤液中再加入AgNO3溶液,若有白色沉淀产生,说明有Cl-;反之,没有;(3)CO32-物质的量为0.025mol;SO42-离子物质的量为0.01mol,根据电荷守恒,肯定存在的阳离子K+在原溶液中的物质的量至少为2×(0.025mol +0.01mol)=0.07mol,溶液的体积为100mL,则K+的浓度为: ![]() =0.7mol/L。
=0.7mol/L。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
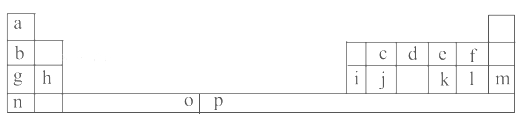
试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
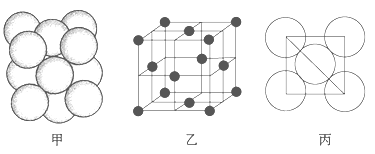
请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。