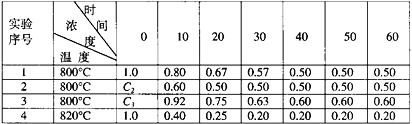
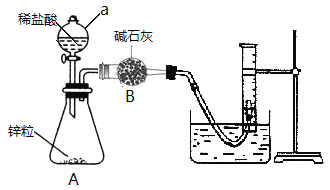
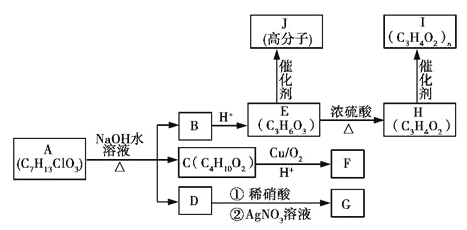
题目内容
【题目】将一定量的钠铝合金置于水中,合金全部溶解,得到 20mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示:
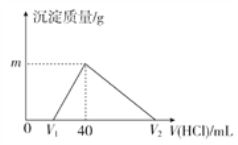
写出有关反应的化学方程式:
(1)______________________________ ;(2)______________________________;
(3)______________________________ ;(4)____________________________ ;
(5)____________________________。
【答案】 略 略 略 略 略
【解析】(1)钠溶于水,与水反应生成氢氧化钠和氢气,方程式为2Na + 2H2O=2NaOH + H2↑;(2)生成的氢氧化钠能与铝反应生成偏铝酸钠和氢气,方程式为 2Al + 2NaOH + 2H2O=2NaAlO2 + 3H2↑ ;(3)根据图像可知滴加盐酸时没有沉淀,说明氢氧化钠过量,发生中和反应:NaOH + HCl=HCl + H2O;(4)氢氧化钠被中和后盐酸与偏铝酸钠反应生成氢氧化铝沉淀,方程式为NaAlO2 + HCl+ H2O=Al(OH)3 ↓+ NaCl;(5)由于氢氧化铝是两性氢氧化物,盐酸过量后发生反应Al(OH)3 + 3HCl=AlCl3 + 3H2O。

练习册系列答案
相关题目