题目内容
【题目】中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO47H2O)]中铁元素的含量。
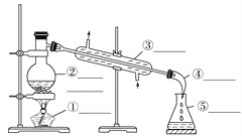
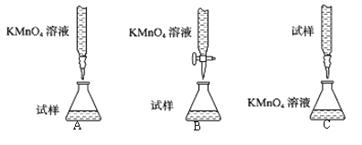
①下列滴定装置中(夹持部分略去),最合理的是:__________(填字母序号)。
②该小组拟在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响。限选试剂与仪器:0.10molL-1FeSO4、0.02molL-1酸性KMnO4、蒸馏水、锥形瓶、试管、胶头滴管、量筒、秒表。参照下表格式,完成实验表格(列出所选试剂体积和数据;数据用字母表示)。_____________、_____________、_____________、_____________。

(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图所示。
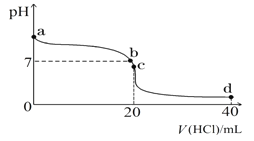
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=__________________。
②取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释:___________________________________。
③d点所示溶液中离子浓度由大到小的排序是_______________________________。
【答案】 B V[0.02molL-1酸性KMnO4]/mL V[ H2O]/mL c b 10-10mol/L 产生白色沉淀(或胶状物)和气泡,NH4+和SiO32-发生双水解反应,2 NH4+ + SiO32- = H2SiO3↓ + 2NH3↑(或2 NH4+ + SiO32-+2H2O = H2SiO3↓ + 2NH3·H2O c(Cl–)>c(H+)>c(NH4+)>c(OH–)
【解析】(1)①用酸性KMnO4溶液滴定某补血剂,高锰酸钾溶液具有强氧化性,能氧化橡胶管,不能用碱式滴定管,所以B符合;故答案为:B;
②在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响,可以选择高锰酸钾溶液和水的体积不同设计,高锰酸钾溶液浓度不同,氧化反应的速率不同,反应达到终点的时间不同,因此可以选择0.10molL-1FeSO4、0.02molL-1酸性KMnO4、蒸馏水、硫酸亚铁浓度相同时,高锰酸钾溶液和水的体积不同,因此选择高锰酸钾溶液体积bmL,水的体积为cmL,和取cmL高锰酸钾溶液,bmL水,故答案为:
V[0.02molL-1酸性KMnO4]/mL | V(H2O)mL | |||
1 | ||||
2 | c | b |
(2)①一水合氨是弱电解质,在水溶液里只有部分电离,电离出氢氧根离子和铵根离子,一水合氨的电离方程式为:NH3H2ONH4++OH-,离子积常数=c(H+)c(OH-),假设溶液的pH=10,则水电离出的氢离子浓度为10-10mol/L,故答案为:10-10mol/L;
②c点时二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解而使溶液中氢离子浓度大于氢氧根离子浓度,则溶液呈酸性,水解离子方程式为:NH4++H2ONH3H2O+H+,取c点时的饱和溶液并向其加入水玻璃,硅酸根离子水解显碱性,铵根离子和硅酸根离子水解相互促进生成白色沉淀硅酸和一水合氨,离子方程式为:SiO32-+2NH4++H2O =H2SiO3↓ +2NH3H2O;故答案为:产生白色沉淀(或胶状物)和气泡;铵根离子和硅酸根离子水解相互促进生成白色沉淀硅酸和一水合氨,离子方程式为:SiO32-+2NH4++H2O =H2SiO3↓ +2NH3H2O;
③d点时,酸的物质的量是氨水的2倍,二者混合时,溶液中的溶质为等物质的量浓度的氯化铵和盐酸,溶液呈酸性,氯化氢完全电离,铵根离子水解但水解程度较小,结合物料守恒知,溶液中离子浓度大小顺序是c (Cl-)>c (H+)>c (NH4+)>c (OH-),故答案为:c(Cl-)>c(H+)>c(NH4+)>c(OH-)。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=_______________________________;
(2)该反应为________(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是__________
A、容器中压强不变
B、混合气体中c(CO)不变
C、混合气体的密度不变
D、c(CO) = c(CO2)
E、单位时间内生成CO的分子数与生成H2O的分子数相等
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为__________℃。