题目内容
【题目】电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。
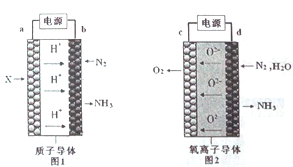
下列说法错误的是
A. a电极上通入的物质是H2
B. 电解池中b是阳极,c是阴极
C. d电极上电极反应式是N2+3H2O+6e-=2NH3+3O2-
D. 若I=2.0A,通电1h,理论上两装置均可得NH3的质量为![]() 。(已知一个电子的电量为1.6×10-19C)
。(已知一个电子的电量为1.6×10-19C)
【答案】B
【解析】通过图1得出b极通入的是N2,所以a极通入的气体应该H2,A说法正确;b极通入的是N2,得到电子,发生还原反应,所以电解池的b极是阴极,c极O2-失去电子,发生氧化反应,c极是阳极,B说法错误;d电极是阴极,N2得到电子生成NH3,总反应式是:2N2+6H2O=4NH3+3O2,所以阴极(d电极)的电极反应式:N2+3H2O+6e-=2NH3+3O2-,C说法正确;当流过的电流1 安培时,每秒钟所通过的电量为 1 库仑,所以I=2.0A,通电1h,理论上电量是:2.0×60×60C,通过的电子:(2.0×60×60)÷(1.6×10-19×NA)mol,1molN原子得到3mol电子生成NH3,所以n(NH3)=(2.0×60×60)÷(1.6×10-19×NA×3)mol, NH3的质量是:m(NH3)=n(NH3)M(NH3)=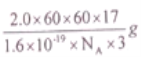 ,D说法正确,本题正确选项B。
,D说法正确,本题正确选项B。

【题目】甲醇是一种重要的有机原料,在催化剂的作用下,CO和H2反应可生成甲醇 (CH3OH) 和副产物CH4,反应如下:
反应①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.0kJ/mol
CH3OH(g) △H1=-90.0kJ/mol
反 应②CO(g)+3H2(g)![]() CH4(g) + H2O(g) △H2
CH4(g) + H2O(g) △H2
反应③ CH4(g)+2H2O(g)![]() CO2(g)+ 4H2(g) △H3=+125.0 kJ/mol
CO2(g)+ 4H2(g) △H3=+125.0 kJ/mol
反应④CO(g)+ H2O(g)![]() CO2(g) + H2(g) △H4=-25.0 kJ /mol
CO2(g) + H2(g) △H4=-25.0 kJ /mol
K1、K2、K3、K4分别表示反应①、②、③、④的平衡常数。
回答下列问题:
(1)反应②的平衡常数的表达式为K2=______________,K2与K3和K4的关系为K2=______________,△H2=____________kJ/mol。
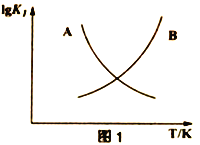
(2)图1中能正确表示反应①的平衡常数(lgK1) 随温度变化的曲线为______________(填曲线字母),其判断理由为______________________________________________________________。
(3)恒温恒容的条件下,下列情况能说明反应①达到平衡状态的是__________________。
A.2v正 (H2)=v逆(CH3OH) B.混合气体的密度不再改变
C.混合气体的平均摩尔质量不再改变 D.混合气体的压强不再改变
(4)为探究不同催化剂对CO和H2生成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1∶3进行实验,得到如下数据:
T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
450 | 10 | CuO-ZnO | 78 |
450 | 10 | CuO-ZnO-ZrO2 | 88 |
450 | 10 | ZnO-ZrO2 | 46 |
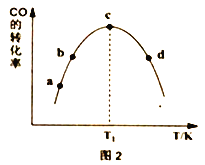
①由表1可知,反应①的最佳催化剂为______________,图2中a、b、c、d四点是该温度下CO平衡转化率的是_________________________________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有_________________。
A.使用催化剂CuO-ZnO-ZrO2 B.适当降低反应温度
C.增大CO和H2的初始投料比 D.恒容下,再充入a molCO和3a mol H2
(5)已知1000℃,反应CO(g)+ H2O(g)![]() CO2(g) + H2(g) K4=1.0。该温度下,在某时刻体系中CO、H2O、CO2、H2的浓度分别为3molL-1、1molL-1、4molL-1、2molL-1,则此时上述反应的v正(CO)_______v逆(CO) (填“>”、“<”或“=”)达到平衡时c(CO)=___________ molL-1。
CO2(g) + H2(g) K4=1.0。该温度下,在某时刻体系中CO、H2O、CO2、H2的浓度分别为3molL-1、1molL-1、4molL-1、2molL-1,则此时上述反应的v正(CO)_______v逆(CO) (填“>”、“<”或“=”)达到平衡时c(CO)=___________ molL-1。