题目内容
【题目】下列有关说法正确的是
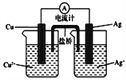
A. 一定条件下反应2SO2+O2![]() 2SO3达到平衡时,v(O2)正=2v(SO3)逆
2SO3达到平衡时,v(O2)正=2v(SO3)逆
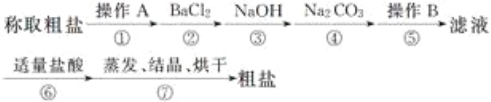
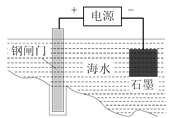
B. 用如图所示方法可保护钢闸门不被腐蚀
C. 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中![]() 的值增大
的值增大
D. 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
【答案】CD
【解析】A. 一定条件下反应2SO2+O2![]() 2SO3达到平衡时,正反应速率等于逆反应速率,2v(O2)正=v(SO3)逆,故A错误;B. 图中钢闸门为阳极,腐蚀速率加快,故B错误;C. NH4Cl溶液中存在,NH4++ H2O
2SO3达到平衡时,正反应速率等于逆反应速率,2v(O2)正=v(SO3)逆,故A错误;B. 图中钢闸门为阳极,腐蚀速率加快,故B错误;C. NH4Cl溶液中存在,NH4++ H2O![]() NH3H2O+ H+,加入少量NaOH固体,c(H+)减小,c(NH3H2O)增大,c(NH4+)减小,则
NH3H2O+ H+,加入少量NaOH固体,c(H+)减小,c(NH3H2O)增大,c(NH4+)减小,则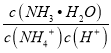 增大,故C正确;D. 常温下,pH=2的HCl溶液中c(H+)与pH=12的Ba(OH)2溶液中的c(OH-)相等,等体积混合,两者恰好完全反应,故D正确;故选CD。
增大,故C正确;D. 常温下,pH=2的HCl溶液中c(H+)与pH=12的Ba(OH)2溶液中的c(OH-)相等,等体积混合,两者恰好完全反应,故D正确;故选CD。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目