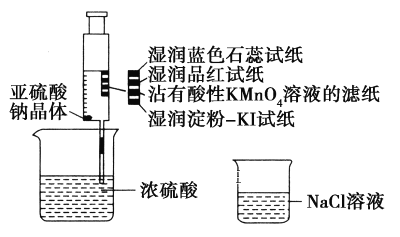
题目内容
【题目】能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系。
(1)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJmol-1)
化学键 | H-H | Cl-Cl | H-Cl |
键能/(kJmol-1) | 436 | 243 | 431 |
根据以上信息可知,1molH2在足量的氯气中燃烧生成氯化氢气体放出的热量是_______
(2)工业上有一种方法是用CO2来生产燃料甲醇,可以将CO2变废为宝。在体积为1L的密闭容器中充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
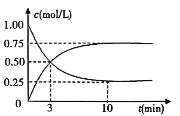
①从反应开始到平衡,CH3OH的平均反应速率υ(CH3OH)=_______________。
②若反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.υ(CO2)=0.15molL-1min-1 B.υ(H2)=0.01molL-1s-1
C.υ(CH3OH)=0.2molL-1min-1 D.υ(H2O)=0.45molL-1min-1
该反应进行由快到慢的顺序为___________(填字母)
(3)海水化学资源的利用具有非常广阔的前景,从海水中提取溴的工业流程如图所示:
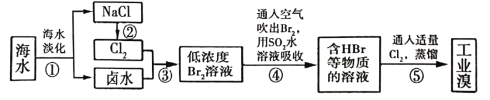
①以上五个过程中涉及氧化还原反应的有_____________个。
②步骤③中已获得游离态的溴,步骤④又随之转变成化合态的溴,其目的是__________。
【答案】183 kJ 0.075mol/(Lmin) D>C=B>A(或D>B = C>A) 4 富集(或浓缩)溴元素
【解析】
利用键能计算反应热时,反应放出的热量应等于生成物的键能总和与反应物的键能总和之差;CH3OH(g)为生成物,物质的量浓度应从0开始,然后不断增大,最终达平衡,其表示的速率应为单体时间内的浓度变化量;利用不同物质的速率比较反应速率的快慢时,须转化为同一种物质,且注意单位的统一。从海水中提取溴,操作①为利用海水蒸发让NaCl结晶析出,卤水中含有Br-;操作②为电解饱和食盐水制Cl2;操作③是将生成的Cl2通入卤水中获得含低浓度Br2的溶液;操作④是利用空气将Br2吹出,然后用SO2水溶液吸收,生成硫酸和氢溴酸;操作⑤是将溶液中的氢溴酸用氯气氧化,所得产物经蒸馏可得纯净的溴蒸气。
(1)由以上分析知,1molH2在足量的氯气中燃烧生成氯化氢气体,放出的热量是2×431kJ-436kJ-243kJ=183 kJ。答案为:183 kJ;
(2)①因为CH3OH为生成物,起始量应为0,所以图中上升的曲线便是CH3OH的浓度变化曲线,CH3OH的平均反应速率υ(CH3OH)=![]() = 0.075mol/(Lmin)。答案为:0.075mol/(Lmin);
= 0.075mol/(Lmin)。答案为:0.075mol/(Lmin);
②为便于比较,利用反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)将四种不同情况下的反应速率分别转化成υ(CO2):
A.υ(CO2)=0.15molL-1min-1 ;
B.υ(H2)=0.01molL-1s-1,υ(CO2)=0.2molL-1min-1 ;
C.υ(CH3OH)=0.2molL-1min-1,υ(CO2)=0.2molL-1min-1 ;
D.υ(H2O)=0.45molL-1min-1,υ(CO2)=0.45molL-1min-1 ;
比较以上数据,可得出该反应进行由快到慢的顺序为D>C=B>A(或D>B = C>A)。答案为:D>C=B>A(或D>B = C>A);
(3)①以上五个过程中涉及氧化还原反应的有②③④⑤,共4个。
②步骤③中已获得游离态的溴,但浓度小,步骤④又随之转变成化合态的溴,但浓度大,所以其目的是富集(或浓缩)溴元素。答案为:4;富集(或浓缩)溴元素。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】某化工小组研究银铜复合废料(表面变黑,生成Ag2S)回收银单质及制备硫酸铜晶体,工艺如下:(废料中的其他金属含量较低,对实验影响可忽略)
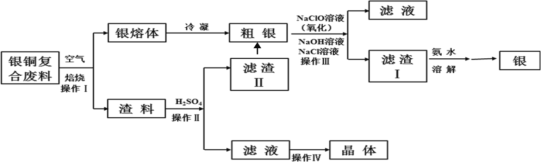
已知:①AgCl可溶于氨水,生成[Ag(NH3)2]+;
②Ksp(Ag2SO4)=1.2×105,Ksp(AgCl)=1.8×1010;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取_______措施(写出其中一种即可)。
(2)操作IV经过________、_______过滤、洗涤和干燥,可以得到硫酸铜晶体。
(3)洗涤滤渣II,与粗银合并,目的是__________。
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为______(其中AgCl和NaCl的物质的量之比为2∶1)。氧化的同时发生沉淀转化,离子方程式为_____,其平衡常数K=__________。
(5)在空气中加热5.20g硫酸铜晶体(CuSO4·5H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。(已知CuSO4·5H2O相对分子质量250)
温度范围/℃ | 固体质量/g |
200~260 | 3.33 |
650~800 | 1.67 |
1000~1500 | 1.50 |
加热到1000℃时,固体物质的化学式为:_______。