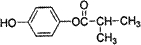
题目内容
16.A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成阳离子、阴离子个数比为2:1的离子化合物丙.(1)D的原子结构示意图为
 ,丙的电子式为
,丙的电子式为 ,E在周期表中的位置为第三周期VA族.
,E在周期表中的位置为第三周期VA族.(2)下列说法正确的有①②③.
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2溶液中无(“有”或“无”)明显现象,若有,请写出对应方程式,若无,请说明原因H2SO3酸性小于盐酸,且亚硫酸钡溶于盐酸
(4)请写出D单质与C的最高价氧化物对应的水化物反应的化学反应方程式:Si+2NaOH+H2O=Na2SiO3+2H2↑.
(5)甲溶液显酸性(填“酸性”、“碱性”或“中性”),原因是NH4++OH-?NH3.H2O+H+(用离子方程式表示).
分析 A、B、C、D、E、F为短周期元素,且原子序数依次增大,A是原子半径最小的元素,则A为H元素;B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲,则为B为N元素,甲为NH4NO3;E与B同主族,则E为P元素;C的阳离子与F的阴离子相差一个电子层,结合原子序数可知,C、D均处于第三周期,F原子序数大于P,且可形成阳离子、阴离子个数比为2:1的离子化合物丙,故F为S、C为Na、丙为Na2S;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,则D为Si、乙为SiH4,据此解答.
解答 解:A、B、C、D、E、F为短周期元素,且原子序数依次增大,A是原子半径最小的元素,则A为H元素;B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲,则为B为N元素,甲为NH4NO3;E与B同主族,则E为P元素;C的阳离子与F的阴离子相差一个电子层,结合原子序数可知,C、D均处于第三周期,F原子序数大于P,且可形成阳离子、阴离子个数比为2:1的离子化合物丙,故F为S、C为Na、丙为Na2S;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,则D为Si、乙为SiH4.
(1)D为Si,原子结构示意图为 ,丙为Na2S,电子式为
,丙为Na2S,电子式为 ,E为P元素,在周期表中的位置为:第三周期VA族,
,E为P元素,在周期表中的位置为:第三周期VA族,
故答案为: ;
; ;第三周期VA族;
;第三周期VA族;
(2)①乙为SiH4,分子只含有极性共价键,故正确;
②同周期自左而右原子半径减小,原子半径由大到小的顺序为C(Mg)>D(Si)>E(P)>F(S),故正确;
③非金属性B(N)>E(P),故B的氢化物更稳定,故正确;
④甲为NH4NO3,含有离子键、共价键,丙为Na2S,只含有离子键,故错误,
故选:①②③;
(3)将F燃烧的产物为SO2,通入BaCl2溶液中,由于H2SO3酸性小于盐酸,且亚硫酸钡溶于盐酸,不能发生反应,无明显现象,
故答案为:无;H2SO3酸性小于盐酸,且亚硫酸钡溶于盐酸.
(4)D单质为Si,C的最高价氧化物对应的水化物为NaOH,二者反应的化学反应方程式:Si+2NaOH+H2O=Na2SiO3+2H2↑,
故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑;
(5)甲为NH4NO3,溶液中NH4+水解:NH4++OH-?NH3.H2O+H+,溶液呈酸性,
故答案为:酸性;NH4++OH-?NH3.H2O+H+.
点评 本题考查位置结构与性质关系的综合应用,涉及常用化学用语、元素周期律、元素化合物性质、盐类水解等,注意对基础知识的理解掌握.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 在燃煤时加入石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO4+2CO2 | |
| B. | 用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3+Na2SO4 | |
| D. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++PbS═CuS+Pb2+ |
| A. | A、Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | NH3$→_{催化剂△}^{O_{2}}$NO$\stackrel{O_{2}}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 | |
| D. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{NaOH(aq)}{→}$Na2SiO3 |
请回答下列问题:
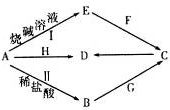
(1)写出F的电子式
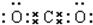 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.(2)写出反应I的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.该反应中的氧化剂是H2O.
(3)反应I、Ⅱ均有清洁能源H2产生.已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态水放出44kJ的热量.其它相关数据如下表:
| O=O(g) | H-H(g) | H-O(g) | |
| 键能/kJ•mol-1 | 496 | x | 463 |
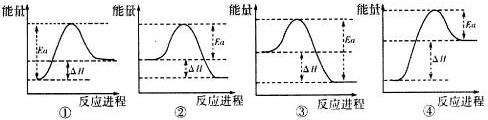
(4)写出A与H反应的化学方程式3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,实验测得该反应的焓变(△H)和活化能(Ea).下列能量关系图合理的是②③(填写序号).
(5)资料显示H可用于除去地下水中的TcO4-(99Tc具有放射性).在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为3Fe3O4+TcO4-+13H2O+H+=TcO2+9Fe(OH)3.
| A. | HCN的结构式:H-C≡N | |
| B. | S2-的结构示意图: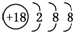 | |
| C. | HClO的电子式: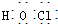 | |
| D. | 质子数为86、中子数为51的铯原子:$\stackrel{137}{86}$Cs |
| A. | 氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 存在于污水中的重金属离子,常用投加明矾等电解质的方法进行处理 | |
| C. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+Al2O3 |
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入少量氯气:Br-+Cl2═Br2+2Cl- | |
| D. | SO2通入溴水中:SO2+Br2+2H2O═2H++SO42-+HBr |
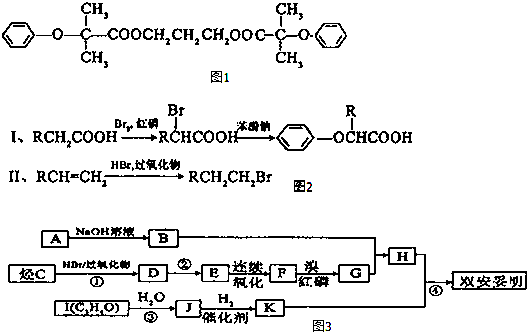
 反应②的条件是氢氧化钠水溶液、加热
反应②的条件是氢氧化钠水溶液、加热