题目内容
14. 在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是b>a>c.
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是b>a=c.
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是c>a>b.
(4)将c(H+)相同的这三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是c>a=b.
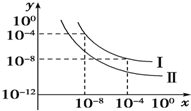
(5)在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示.请回答下列问题:
①曲线Ⅰ代表的温度下,水的离子积为1×10-12,曲线Ⅰ所代表的温度高于(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度.你判断的依据是曲线Ⅱ所代表的水的离子积比曲线Ⅰ的小,由于水的电离过程是吸热过程,温度越高,离子积越大,故曲线Ⅱ代表的温度低.
②曲线Ⅰ所代表的温度下,0.01mol/L的NaOH溶液的pH为10.
分析 (1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸,假设三种酸的浓度都是1mol/L时,硫酸中c(H+)为2mol/L,盐酸中c(H+)为1mol/L、醋酸中c(H+)小于1mol/L;
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力与酸最终电离出氢离子的物质的量成正比;
(3)若三者c(H+)相同时,酸的元数越大其浓度越小,酸的电离程度越大,其浓度越小;
(4)加水稀释促进弱电解质电离;
(5)①当溶液中温度一定时,溶液中离子积常数Kw=c(H+).c(OH-);水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大;
②该温度下,水的离子积常数为为10-12,0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,根据水的离子积常数计算溶液中c(H+),从而确定溶液的pH.
解答 解:(1)醋酸是一元弱酸、盐酸是一元强酸、硫酸是二元强酸,假设三种酸的浓度都是1mol/L时,硫酸中c(H+)为2mol/L,盐酸中c(H+)为1mol/L、醋酸中c(H+)小于1mol/L,所以相同浓度时,氢离子浓度大小顺序是b>a>c,
故答案为:b>a>c;
(2)酸中和NaOH的能力与酸最终电离出氢离子物质的量成正比,同体积、同物质的量浓度的三种酸,其物质的量相等,硫酸中氢离子的物质的量最大,盐酸和醋酸最终电离出氢离子的物质的量相等,所以中和NaOH的能力大小顺序为b>a=c,
故答案为:b>a=c;
(3)若三者c(H+)相同时,假设都是1mol/L,硫酸浓度为0.5mol/L、盐酸浓度为1mol/L、醋酸浓度大于1mol/L,所以物质的量浓度由大到小的顺序是c>a>b(或c>a=2b),
故答案为:c>a>b(或c>a=2b);
(4)加水稀释时,醋酸继续电离出氢离子,硫酸和HCl不再电离出氢离子,所以稀释100倍后,c(H+)由大到小的顺序是c>a=b,
故答案为:c>a=b;
(5)①当溶液中温度一定时,溶液中离子积常数Kw=c(H+)•c(OH-),曲线Ⅰ代表的温度下,水的离子积=10-4×10-8=1×10-12;水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,根据图象知,曲线Ⅱ所代表的温度水的离子积常数减小,所以线Ⅰ所代表的温度高于曲线Ⅱ所代表的温度,
故答案为:1×10-12;高于; 曲线Ⅱ所代表的水的离子积比曲线Ⅰ的小,由于水的电离过程是吸热过程,温度越高,离子积越大,故曲线Ⅱ代表的温度低;
②该温度下,水的离子积常数为10-12,0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,根据水的离子积常数得溶液中c(H+)=$\frac{1{0}^{-12}}{0.01}$mol/L=10-10mol/L,则该溶液的pH=10,
故答案为:10.
点评 本题考查了弱电解质的电离,题目难度中等,明确弱电解质电离特点是解本题关键,注意同物质的量的不同酸中和碱的能力、不同酸与金属反应速率与电解质强弱无关,为易错点.

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案请回答下列问题:
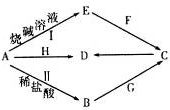
(1)写出F的电子式
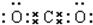 ,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
,实验室制取G的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.(2)写出反应I的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.该反应中的氧化剂是H2O.
(3)反应I、Ⅱ均有清洁能源H2产生.已知H2的燃烧热为286kJ•mol-1,18g水蒸气变成液态水放出44kJ的热量.其它相关数据如下表:
| O=O(g) | H-H(g) | H-O(g) | |
| 键能/kJ•mol-1 | 496 | x | 463 |
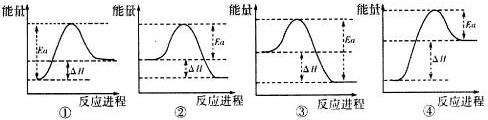
(4)写出A与H反应的化学方程式3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,实验测得该反应的焓变(△H)和活化能(Ea).下列能量关系图合理的是②③(填写序号).
(5)资料显示H可用于除去地下水中的TcO4-(99Tc具有放射性).在酸性条件下,H将TcO4-转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为3Fe3O4+TcO4-+13H2O+H+=TcO2+9Fe(OH)3.
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入少量氯气:Br-+Cl2═Br2+2Cl- | |
| D. | SO2通入溴水中:SO2+Br2+2H2O═2H++SO42-+HBr |
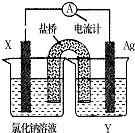 依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )
依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )| A. | 电极X的材料是Fe | |
| B. | 电解质溶液Y是AgNO3溶液 | |
| C. | 原电池工作时,X电极反应为:Fe-2e-=Fe2+ | |
| D. | 原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中 |
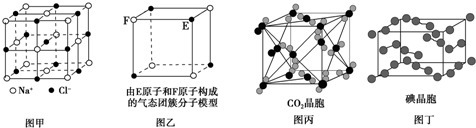
| A. | 在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体 | |
| B. | 该气态团簇分子(图乙)的分子式为E4F4或F4E4 | |
| C. | 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻 | |
| D. | 在碘晶体(图丁)中,碘分子的排列只有一种方向 |
| A. | 钠和水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 氧化钠与水反应:Na2O+H2O═2Na++2OH- | |
| C. | NaHCO3溶液与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | Na2CO3溶液与BaCl2溶液反应:CO32-+Ba2+═BaCO3↓ |
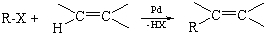
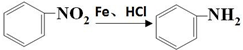

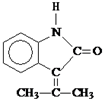 .
.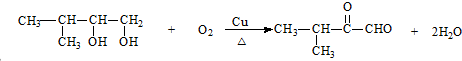 ;F→G:
;F→G: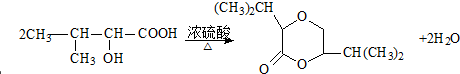 .
.