题目内容
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为___nm(填字母)。
A.435 B.500 C.580 D.605 E.700
(2)元素S和Ca中,第一电离能较大的是________(填元素符号),其基态原子外围电子排布式为________。其基态原子中电子的空间运动状态有________种。
(3)硫的最高价氧化物的水合物硫酸能与肼反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________ (填字母)。
A.离子键 B.共价键 C.配位键 D.范德华力
(4)基态Ca原子中,核外电子占据最高能层的符号是________, 该能层为次外层时最多可以容纳的电子数为________。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________________。
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρg·cm-3,则晶胞结构中最近的两个Ca2+间的距离为______________________nm(列算式即可,用NA表示阿伏加德罗常数的数值)。与Ca2+紧邻O22-的个数为________。

【答案】 E S 3s23p4 9 D N 18 Ca原子半径较大且价电子数较少,金属键较弱  6
6
【解析】(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为700nm,故选E;
(2)S原子吸引电子的能力大于Ca原子,第一电离能较大的是S,S是16号元素,基态原子外围电子排布式为3s23p4。S的基态原子中电子的空间运动状态有1s、2s、2px、2py、2pz、3s、3px、3py、3pz,共9种空间运动状态,故答案为:S;3s23p4;9;
(3)N2H6SO4和(NH4)2SO4都是离子晶体,N2H6 2+和SO42-之间存在离子键,N2H62+中N和H之间形成6个共价键(其中2个配位键),N和N之间形成共价键,SO42-中S和O之间形成共价键,不含范德华力,故选D;
(4)基态Ca原子含有4个电子层,核外电子占据最高能层的符号是N,原子核外次外层的电子数不超过18个。Ca原子半径较大且价电子数较少,导致钙中金属键较弱,使得金属钙的熔点、沸点等都比金属锰低,故答案为:N;18;Ca原子半径较大且价电子数较少,金属键较弱;
(5)根据晶胞结构图,晶胞中Ca2+数为8×![]() +6×
+6×![]() =4,O22-的数为1+12×
=4,O22-的数为1+12×![]() =4。1mol晶胞的质量为4×72g,1mol晶胞的体积为
=4。1mol晶胞的质量为4×72g,1mol晶胞的体积为![]() =
=![]() cm3,则晶胞的边长为
cm3,则晶胞的边长为 cm=
cm=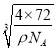 ×107 nm,晶胞结构中最近的两个Ca2+间的距离为晶胞边长的
×107 nm,晶胞结构中最近的两个Ca2+间的距离为晶胞边长的![]() ,即距离为
,即距离为![]() ×
× ×107 nm;根据晶胞结构图,与Ca2+紧邻O22-的个数为6个,故答案为:
×107 nm;根据晶胞结构图,与Ca2+紧邻O22-的个数为6个,故答案为: ![]() ×
×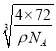 ×107;6。
×107;6。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案