题目内容
13.对二氧化氮的下列说法不正确的是( )| A. | 二氧化氮不是硝酸的酸酐 | |
| B. | 二氧化氮与水的反应是氧化还原反应 | |
| C. | 二氧化氮不是造成大气污染的气体之一 | |
| D. | 在通常状况下测得的NO2的相对分子质量是不准确的 |
分析 二氧化氮为红棕色气体,密度比空气密度大,二氧化氮能够与水反应生成一氧化氮和硝酸,二氧化氮是形成酸雨的主要成分之一,以此解答该题.
解答 解:A.二氧化氮中N元素化合价为+5价,硝酸中N元素化合价为+5价,化合价不相等,则二氧化氮不是硝酸的酸酐,故A正确;
B.二氧化氮和水反应合成NO和硝酸,N元素化合价发生变化,发生氧化还原反应,故B正确;
C.二氧化氮是形成酸雨的主要成分之一,且可形成光化学污染,故C错误;
D.二氧化氮可生成四氧化二氮,为可逆反应,则在通常状况下测得的NO2的相对分子质量是不准确的,故D正确.
故选C.
点评 本题考查了二氧化氮的物理性质、化学性质,题目难度不大,注意掌握氮的氧化物性质及对环境的影响,明确二氧化氮为红棕色气体、一氧化氮为无色气体.

练习册系列答案
相关题目
3.已知可逆反应:X(g)+3Y(g)═2Z(g)△H<0,甲、乙为恒容、等体积的真空密闭容器,向甲中加入1molX和 3molY,在一定条件下达到平衡时放出热量为Q1KJ.在相同条件下,向乙容器中加入2molZ,达到平衡时吸收热量Q2KJ,已知 Q1=3Q2.下列叙述正确的是( )
| A. | 平衡时甲、乙中Z的体积分数甲>乙 | |
| B. | 平衡时甲中X的转化率为75% | |
| C. | 达到平衡后,再向乙中加入0.25molX,0.75molY和1.5molZ,平衡向生成x的方向移动 | |
| D. | 乙中反应的热化学方程式:2Z(g)═X(g)+3Y(g)△H=+Q2kJ•mol-1 |
4.下列分子中,中心原子以sp3杂化且属于极性分子的是( )
| A. | CCl4 | B. | BF3 | C. | CO | D. | NH3 |
8.下列结论是从某同学的笔记本上摘录的,你认为其中肯定正确的是( )
①微粒半径Cl->S2->S>F ②氢化物的稳定性 HF>HCl>H2S>H2Se ③还原性S2->Cl->Br->I- ④氧化性 Cl2>S>Se>Te ⑤酸性 H2SO4>HClO4>H2SeO4 ⑥得电子能力F>Cl>Br>I.
①微粒半径Cl->S2->S>F ②氢化物的稳定性 HF>HCl>H2S>H2Se ③还原性S2->Cl->Br->I- ④氧化性 Cl2>S>Se>Te ⑤酸性 H2SO4>HClO4>H2SeO4 ⑥得电子能力F>Cl>Br>I.
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
10.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+ (对苯醌)═N2H4+
(对苯醌)═N2H4+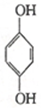 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为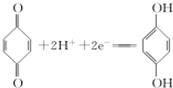 .
.
(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
①写出该反应的化学平衡常数的表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,b小于(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
(1)利用对苯醌质子电池可检测氨气,其电池反应原理为2NH3+
 (对苯醌)═N2H4+
(对苯醌)═N2H4+ (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为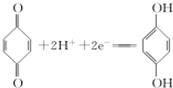 .
.(2)25℃时,将nmol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①若混合溶液中c(NH4+)=c(Cl-),则溶液的pH=7.
②若混合溶液中c(NH4+)>c(Cl-),则反应的情况可能为a.
a、盐酸不足,氨水剩余 b、氨水与盐酸恰好反应 c、盐酸过量
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3N2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的u正(N2)小于(填“大于”“小于”或“等于”)u正(N2).
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8KJ/mol.
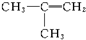 属于同类(“同类”或“不同类”)物质,分子式为C4H8,二者属于碳链异构体.
属于同类(“同类”或“不同类”)物质,分子式为C4H8,二者属于碳链异构体.
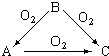 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.