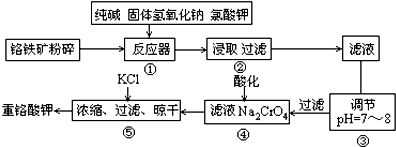
题目内容
12. Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.(1)C、N、O三种元素的第一电离能由大到小的顺序为N>O>C,与N3-含有相同电子数的三原子分子的空间构型是V形.
(2)Cu+电子排布式为1s22s22p63s23p63d10,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO何会生成Cu2O:Cu+价电子排布式为3d10,为全充满结构,更稳定.
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是sp2、sp3,乙醛分子中H-C-O的键角大于(填“大于”“等于”或“小于”)乙醇分子中的H-C一0的键角.
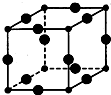
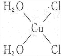
(4)[Cu(H20)4]2+为平面正方形结构,其中的两个H20被Cl-取代有两种不同的结构,试画出[Cu(H20)2(C1)2]具有极性的分子的结构式:
 .
.(5)Cu3N的晶胞结构如右图,N3-的配位数为6,Cu+半径为a pm,N3-半径为b pm,Cu3N的密度$\frac{103×1{0}^{-30}}{4(a+b)^{3}{N}_{A}}$g•cm-3.(阿伏加德罗常数用NA表示)
分析 (1)同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;与N3-含有相同电子数的三原子分子为O3,根据价层电子对互斥理论确定其空间构型;
(2)Cu+核外有28个电子,Cu原子核外有29个电子,其基态原子电子排布式为1s22s22p6 3s23p63d104s1,Cu原子失去最外层一个电子生成Cu+,根据构造原理书写Cu+核外电子排布式;原子轨道中电子处于全空、全满或半满时原子最稳定;
(3)根据价层电子对互斥理论确定分子空间构型,根据分子空间构型确定键角大小;
(4)[Cu(H20)4]2+为平面正方形结构,其中的两个H20被Cl-取代有两种不同的结构,[Cu(H20)2(C1)2]分子为极性分子,说明该分子中相同基团位于相邻位置;
(5)该晶胞中大球个数=12×$\frac{1}{4}$=3,小球个数=8×$\frac{1}{8}$=1,根据其化学式知,小球为N3-、大球为Cu+,N3-的配位数为6,该晶胞棱长=(2a+2b)pm=(2a+2b)×10-10cm,晶胞体积=(2a+2b)3×10-30cm3,晶胞密度=$\frac{m}{V}$.
解答 解:(1)同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,这三种元素位于同一周期,且C、N、O分别位于第IVA族、VA族、VIA族,所以第一电离能大小顺序是N>O>C;
与N3-含有相同电子数的三原子分子为O3,以其中一个O原子为中心原子,剩余两个O原子为配原子,其价层电子对个数是3且含有一个孤电子对,所以为V形结构,
故答案为:N>O>C;
(2)Cu+核外有28个电子,Cu原子核外有29个电子,其基态原子电子排布式为1s22s22p6 3s23p63d104s1,Cu原子失去最外层一个电子生成Cu+,根据构造原理知Cu+核外电子排布式为1s22s22p6 3s23p63d10;原子轨道中电子处于全空、全满或半满时原子最稳定,Cu+价电子排布式为3d10,为全充满结构,更稳定,所以高温下CuO何会生成Cu2O,
故答案为:1s22s22p6 3s23p63d10;Cu+价电子排布式为3d10,为全充满结构,更稳定;
(3)乙醛分子中甲基上C原子价层电子对个数是4,所以采用sp3杂化,醛基上碳原子价层电子对个数是3且不含孤电子对,所以采用sp2杂化;
乙醛分子中醛基为平面三角形结构,乙醇分子中含有羟基的C原子和其连接的基团为正四面体结构,所以乙醛分子中H-C-O的键角大于乙醇分子中的H-C一0的键角,
故答案为:sp2、sp3;大于;
(4)[Cu(H20)4]2+为平面正方形结构,其中的两个H20被Cl-取代有两种不同的结构,[Cu(H20)2(C1)2]分子为极性分子,说明该分子中相同基团位于相邻位置,其结构式为 ,故答案为:
,故答案为: ;
;
(5)该晶胞中大球个数=12×$\frac{1}{4}$=3,小球个数=8×$\frac{1}{8}$=1,根据其化学式知,小球为N3-、大球为Cu+,N3-的配位数为6,该晶胞棱长=(a+b)pm=(2a+2b)×10-10cm,晶胞体积=(2a+2b)3×10-30cm3,晶胞密度=$\frac{m}{V}$=$\frac{\frac{206}{{N}_{A}}×1}{(2a+2b)^{3}×1{0}^{-30}}$g•cm-3=$\frac{103×1{0}^{-30}}{4(a+b)^{3}{N}_{A}}$g•cm-3,
故答案为:6;$\frac{103×1{0}^{-30}}{4(a+b)^{3}{N}_{A}}$.
点评 本题考查晶胞计算、微粒空间构型判断、原子杂化方式判断、原子核外电子排布等知识点,侧重考查分析、计算、空间想象能力,明确均摊法、价层电子对互斥理论、构造原理等知识点即可解答,难点是晶胞计算方法,题目难度中等.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案①在点燃H2、CO、CH4等易燃性气体前,必须检验气体的纯度.
②在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌.
③浓碱对皮肤有腐蚀作用,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸溶液.
④给试管中的液体加热时,液体不超过试管容积的$\frac{1}{3}$
⑤点燃添满酒精的酒精灯.
| A. | 仅①② | B. | 仅①②③ | C. | 仅①②③④ | D. | 全部 |
| A. | 平衡时甲、乙中Z的体积分数甲>乙 | |
| B. | 平衡时甲中X的转化率为75% | |
| C. | 达到平衡后,再向乙中加入0.25molX,0.75molY和1.5molZ,平衡向生成x的方向移动 | |
| D. | 乙中反应的热化学方程式:2Z(g)═X(g)+3Y(g)△H=+Q2kJ•mol-1 |
| A. | H2O | B. | BF3 | C. | COCl2 | D. | SF6 |
| A. | ①③⑤ | B. | ②④ | C. | ③⑤ | D. | ②③⑤ |
| A. | CCl4 | B. | BF3 | C. | CO | D. | NH3 |
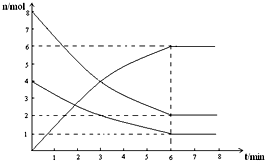 在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:
在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示: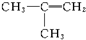 属于同类(“同类”或“不同类”)物质,分子式为C4H8,二者属于碳链异构体.
属于同类(“同类”或“不同类”)物质,分子式为C4H8,二者属于碳链异构体.