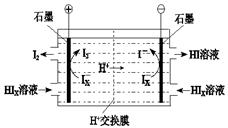
题目内容
已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释NaHC2O4溶液显酸性的原因:________________。
(2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较所得溶液中各种离子浓度的大小关系:________________。
(3)配平以下氧化还原反应方程式。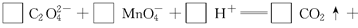
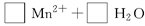
(4)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份该溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加20 mL 0.25 mol/L NaOH溶液时,溶液由无色变为浅红色。该溶液中被中和的H+的物质的量为________mol。
②第二份溶液中滴加16mL 0.10mol/L酸性KMnO4溶液时反应完全,该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的物质的量为________mol,KHC2O4的质量分数为________。
(1)HC2O4+ H++C2O42—
H++C2O42—
(2)c(Na+)>c(C2O42—)>c(OH-)>c(HC2O4+)>c(H+)
(3)5 2 16 10 2 8
(4)①0.005 ②4×10-3 ③10-2 64%
解析

 状元坊全程突破导练测系列答案
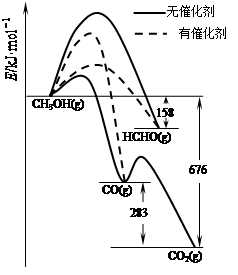
状元坊全程突破导练测系列答案(8分)无论是从在国民经济中的地位来看,还是从科学发展的角度来看,硅都发挥着重要的作用。
(1)人类使用硅酸盐产品(陶瓷等)的历史已经快一万年了,但在1823年才获得单质硅,瑞典化学家贝采尼乌斯用金属钾还原SiF4获得单质硅,写出化学方程式_______________ 。
(2)由于制取方法和条件的不同,得到的单质硅形态不同,其性质也不同。
①用铝热法还原氟硅酸钾制得较纯净的晶体硅:4Al+3K2SiF6高温3Si+2KAlF4+2K2AlF5,关于该反应的说法正确的是________(填序号)。
| A.Al是还原剂 | B.氧化产物只有KAlF4 |
| C.每转移6NA电子,得到42 g Si | D.Al元素在KAlF4和K2AlF5中化合价不同 |
(3)在野外,为了迅速得到氢气,用硅粉与干燥的Ca(OH)2和NaOH混合,并加强热,即可迅速得到H2、Na2SiO3、CaO。这种混合物叫做生氢剂。请写出该反应的化学方程式___________________________。
溴的氧化性介于氯和碘之间,利用这一性质解决下面的问题。
(1)你认为:将含有下列哪种分子或离子的试剂加入到含有Br-的溶液中,可以将Br-氧化为Br2__________。
| A.I2 | B.I | C.Cl2 | D.Cl- |
(3)把滤纸用淀粉和碘化钾的混合溶液浸泡,晾干后就是实验室常用的淀粉碘
化钾试纸。这种试纸润湿后遇到氯气发生的变化是_____________,原因是_________________________________________。
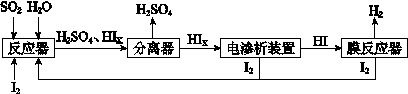
某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案: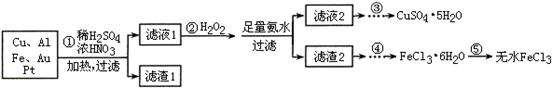
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液(mL) | 25.00 | 25.02 | 26.20 | 24.98 |
此产品中CuSO4·5H2O的质量分数为 。
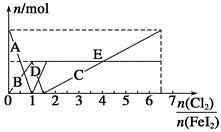
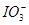 、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。
、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。