题目内容
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,含VO2+、K+、SO42-等。写出该反应的化学方程式_________________________________。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向______________________。
(3)在20.00 mL的0.1 mol·L-1 VO2+溶液中,加入0.195 g锌粉,恰好完成反应,则还原产物可能是______________________________________________________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+__________________________________。
(1)V2O5+K2SO3+2H2SO4=2VOSO4+K2SO4+2H2O
(2)ClO3-+6V6e-O2++3H2O=Cl-+6VO2++6H+
(3)b
(4)Cl2+SO32-+H2O=2Cl-+2H++SO42-
解析

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
某学生往一支试管里按一定次序分别加入下列几种物质:
| A.KI溶液, | B.淀粉溶液, | C.NaOH溶液, | D.氯水。发现溶液颜色按下面次序变化: |
依据溶液颜色的变化回答下列问题:
(1)加入以上药品的顺序是_________________________________________________。
(2)写出①→②的离子反应方程式,若为氧化还原反应,请标明电子转移的方向和总数:_______________________________________________________________________。
(3)写出③→④的化学反应方程式:___________________________________________。

 Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答:
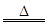 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O