题目内容
【题目】25 ℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A.25 ℃时,H2CO3的一级电离Ka1(H2CO3)=1.0×10-6.4
B.M点溶液中:c(H+)+ c(H2CO3)=c(Cl-) +2c(CO32-) +c(OH-)
C.25 ℃时,HC![]() +H2O
+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.图中a=2.6
【答案】B
【解析】
A. 25 ℃时,当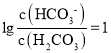 即
即 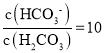 时,pH=7.4,H2CO3的一级电离Ka1(H2CO3)=
时,pH=7.4,H2CO3的一级电离Ka1(H2CO3)=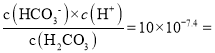 1.0×10-6.4,故A正确;
1.0×10-6.4,故A正确;
B. 根据电荷守恒、物料守恒, M点溶液中:c(H+)+ c(H2CO3)=c(Cl-) +c(CO32-) +c(OH-),故B错误;
C. 25 ℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=
H2CO3+OH-的Kh=![]() 1.0×10-7.6,故C正确;
1.0×10-7.6,故C正确;
D. 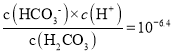 ,图中M点pH=9,
,图中M点pH=9,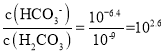 ,所以a=2.6,故D正确;
,所以a=2.6,故D正确;
选B。

练习册系列答案
相关题目