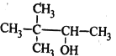
题目内容
【题目】三氧化钼(MoO3)是石油工业中常用的催化剂,也是搪瓷釉药的颜料,该物质常使用辉钼矿(主要成分
为MoS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
则2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H=______(用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下仅发生反应MoS2(s)Mo(s)+S2(g)
①下列说法正确的是______(填字母)。
a.气体的密度不变,则反应一定达到了 平衡状态
b.气体的相对分子质量不变,反应不定处于 平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4 molL-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度______(填“>“<“或“=“)1.4 molL-1。
(3)在2L恒容密闭容器中充入1.0 molS2(g)和1.5 mol O2(g),若仅发生反应:S2(g)+2O2(g)2SO2(g),5 min后反应达到平衡,此时容器压强为起始时的80%,则0~5 min内,S2(g)的反应速率为______molL-1min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H.测得氧气的平衡转化率与起始压强、温度的关系如图所示:
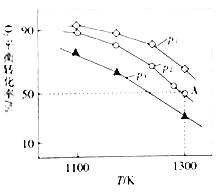
①△H______(填“>“*<“或“=“)0;比较p1、p2、p3的大小:______
②若初始时通入7.0molO2,p2为7.0 kPa,则A点平衡常数Kp=______(用气体平衡分压代替气体平衡浓度计算。分压=总压×气体的物质的量分数,写出计算式即可)。
【答案】2H1+2H2+H3 ab = 0.05 < p1>p2>p3 ![]() (kPa)-3(或
(kPa)-3(或![]() )
)
【解析】
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
利用盖斯定律,将2×①+2×②+③,即可求出MoS2(s)+7O2(g)2MoO3(s)+4SO2(g)。
(2)若在恒温恒容条件下仅发生反应MoS2(s)Mo(s)+S2(g)
①a.平衡移动时,气体的质量改变,密度改变;
b.气体只有S2一种,相对分子质量始终不变;
c.增加MoS2(s)的量,平衡不受影响。
②利用平衡常数进行分析,反应再次达到平衡,S2(g)浓度与1.4 molL-1的关系。
(3)利用三段式,求出S2的物质的量的变化量,从而求出0~5 min内,S2(g)的反应速率。
(4)①采集图象信息,压强不变时,升高温度,O2的平衡转化率减小;温度不变时,O2的平衡转化率由大到小变化时,对应压强顺序为p1、p2、p3。
②若初始时通入7.0molO2,p2为7.0 kPa,图中信息显示,A点时O2的平衡转化率为50%,由此可求出平衡常数Kp。
(1)已知:①MoS2(s)Mo(s)+S2(g) △H1;
②S2(g)+2O2(g)2SO2(g) △H2;
③2Mo(s)+3O2(g)2MoO3(s) △H3
利用盖斯定律,将2×①+2×②+③,即可求出MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) △H=2H1+2H2+H3。答案为:△H=2H1+2H2+H3;
(2)若在恒温恒容条件下仅发生反应MoS2(s)Mo(s)+S2(g)
①a.平衡移动时,气体的质量改变,密度改变,密度不变时,表明反应达平衡状态,a符合题意;
b.气体只有S2一种,相对分子质量始终不变,平衡不一定达平衡状态,b符合题意;
c.增加MoS2(s)的量,平衡不受影响,c不合题意。故选ab。答案为:ab;
②平衡常数K=c(S2),温度不变时,K值不变,c(S2)不变,c(S2)=1.4 molL-1。答案为:=;
(3)设参加反应的S2的物质的量为x
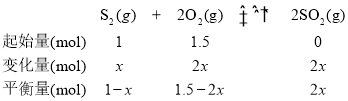
![]() ,x=0.5mol,则0~5 min内,S2(g)的反应速率为
,x=0.5mol,则0~5 min内,S2(g)的反应速率为![]() =0.05molL-1min-1。
=0.05molL-1min-1。
答案为:0.05;
(4)①采集图象信息,压强不变时,升高温度,O2的平衡转化率减小,则平衡逆向移动,△H<0;温度不变时,增大压强,平衡正向移动,O2的平衡转化率增大,图中信息告诉我们,O2的平衡转化率增大,对应压强顺序为p1、p2、p3,由此得出p1>p2>p3。答案为:<;p1>p2>p3;
②三段式为
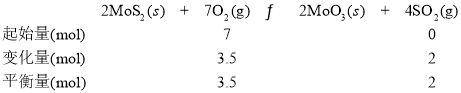
温度、容积不变时,压强之比等于物质的量之比,若初始时通入7.0molO2,压强为7.0 kPa,则达平衡时,压强应为5.5 kPa,平衡常数Kp =
=![]() (kPa)-3(或
(kPa)-3(或![]() )。答案为:
)。答案为:![]() (kPa)-3(或
(kPa)-3(或![]() )。
)。

 阅读快车系列答案
阅读快车系列答案