题目内容
16.(1)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1.则V为8.4L<V<13.44L.(2)为测定镀锌铁皮锌镀层的厚度,将镀锌皮与足量盐酸反应,特产生的气泡明显减少时取出,洗涤,烘干,称重,关于该实验的操作对测定结果的影响判断正确的是C
A.铁皮未及时取出,会导致测定结果偏小
B.铁皮未洗涤干净,会导致测定结果偏大
C.烘干时间过长,回导致测定结果偏小
D.若把盐酸换成硫酸,会导致测定结果偏大.
分析 (1)利用极限法解答,假设混合物全是CuS,或混合物全是Cu2S,根据n=$\frac{m}{M}$计算n(CuO),根据电子转移守恒计算n(CuS)、n(Cu2S),再根据电子转移数目守恒,计算n(NO)、n(NO2),根据V=nVm计算气体体积,实际气体介于二者之间;
(2)测定镀锌铁皮的锌镀层厚度是根据铁皮的面积测定电镀前后铁皮质量的增重,进而可计算锌镀层的厚度,
过迟判断反应终点导致部分铁溶解,w1-w2偏大而引起结果偏高,过早判断反应终点、铁皮未烘干就去称重则使 w1-w2 偏小而引起结果偏低,烘干时间过长(铁被氧化),则剩余物的质量偏大.
解答 解:(1)若混合物全是CuS,其物质的量n(CuS)=n(CuO)=$\frac{12g}{80g/mol}$=0.15mol,转移电子物质的量=0.15×(6+2)=1.2mol.NO和NO2的体积相等,设NO的物质的量为x、NO2的物质的量为x,则3x+x=1.2,解得x=0.3,故气体体积V=0.6mol×22.4L/mol=13.44L;
若混合物全是Cu2S,其物质的量n(Cu2S)=$\frac{1}{2}$n(CuO)=$\frac{1}{2}$×0.15mol=0.075mol,转移电子物质的量0.075×10=0.75mol,设NO为xmol、NO2为xmol,3x+x=0.75,计算得x=0.1875,气体体积0.1875mol×2×22.4L/mol=8.4L,
故答案为:8.4L<V<13.44L;
(2)A、铁皮未及时取出,导致部分铁溶解,质量差w1-w2偏大,引起结果偏高,故A错误;
B、铁皮未洗涤干净,导致反应后的质量变大,质量差 w1-w2偏小,引起结果偏低,故B错误;
C、烘干时间过长(铁被氧化),则剩余物的质量偏大,导致测定结果偏小,故C正确;
D、若把盐酸换成硫酸,对测定结果没有影响,故D错误;
故答案为:C.
点评 本题考查氧化还原反应计算,为高频考点,难度中等,注意守恒思想与极限法的利用,是对学生综合能力的考查,同时注意注意把握实验操作原理以及注意事项.

 阅读快车系列答案
阅读快车系列答案| A. | $\frac{125a}{9V}$mol/L | B. | $\frac{125a}{18V}$mol/L | C. | $\frac{125a}{36V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
| A. | CO2 | B. | PCl5 | C. | NF3 | D. | AlCl3 |
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 原子最外层电子数:F>S>Ca |
酸溶FeTiO3(S)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解TiOSO4(aq)+2H2O(l)$\frac{\underline{\;90℃\;}}{\;}$H2TiO3(S)+H2SO4(aq)
简要工艺流程如下:
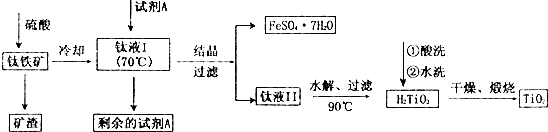
过量的试剂A除去的方法为( )
| A. | 过滤 | B. | 蒸发浓缩冷却结晶过滤 | ||
| C. | 水洗 | D. | 灼烧 |
| A. | 制备硝基苯,混合药品的顺序为:向试管中先加入苯,再加入浓硫酸,最后加入浓硝酸 | |
| B. | 银镜反应、乙醛与新制Cu(OH)2反应、实验室制取乙烯都必须用水浴加热 | |
| C. | 在重结晶的实验中,使用长颈漏斗趁热过滤是为了减少被提纯物质的损失 | |
| D. | 苯甲酸的重结晶实验中要得到纯净的苯甲酸固体需要进行至少两次过滤操作 |
| A. | 用玉米酿酒 | B. | 用浓硫酸干燥氧气 | ||
| C. | 用稀硫酸除铁锈 | D. | 用铁矿石冶炼生铁 |
 乙苯
乙苯  2,3-二甲基戊烷
2,3-二甲基戊烷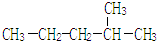 2-甲基戊烷
2-甲基戊烷 .
.