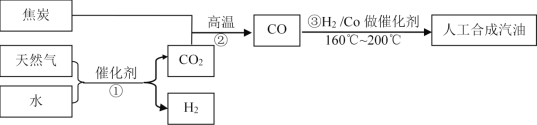
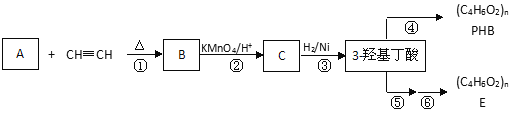
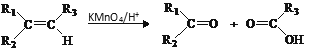
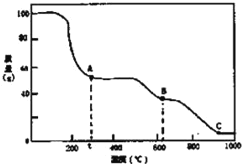
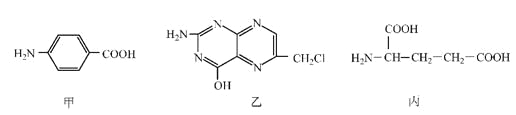
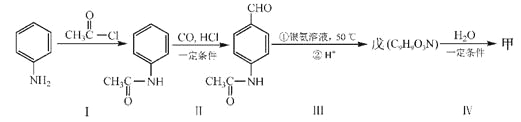
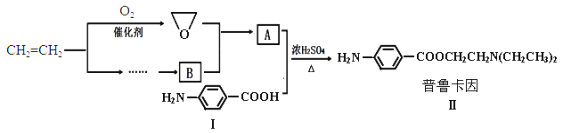
题目内容
【题目】方法与规律提炼:
(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
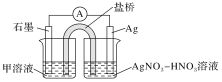
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag+Fe3+能够发生的实验操作及现象是_________________________
(2)用零价铁(Fe)去除水体中的硝酸盐(NO![]() )已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
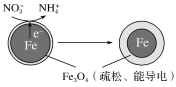
上图中作负极的物质是___________。正极的电极反应式是______________。
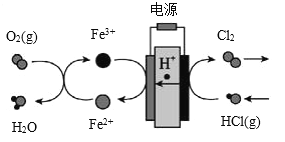
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。 电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
(4)KClO3也可采用“电解法”制备,装置如图所示。
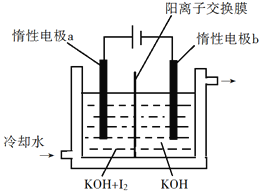
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____
【答案】负 FeSO4 或FeCl2溶液 分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色加深 铁 NO3-+8e-+10H+=NH4++3H2O Fe3++e-= Fe2+ 5.6L 2H++2e-= H2 ↑ K+ a→b 原电池中先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失;注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。电解池中电极反应式的书写看阳极材料,如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写。
【解析】
根据原电池原理,负极发生氧化反应;根据电解池原理,阴极发生还原反应,通过物质的化合价变化判断反应发生原理,阳离子移动方向与电子移动方向相同,据此回答问题。
(1) 已知电池总反应为反应Ag++Fe2+=Ag+Fe3+,银离子化合价降低,得到电子,作正极,故石墨一侧仅为导电材料,作负极,甲溶液是含Fe2+的溶液,可以为FeSO4 或FeCl2溶液。证明反应能够发生,实际上即证明有Fe3+生成,实验操作及现象是分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色加深。
(2) 由图可知,电子从铁电极移到外侧,故铁电极失去电子,发生氧化反应,做负极。正极NO3-得到电子变为NH4+,NO3-+8e-+10H+=NH4++3H2O;
(3)由题可知,HCl失去电子变为Cl2,发生氧化反应,做阳极。阴极区的电极反应式为Fe3++e-= Fe2+, 外侧Fe2+与氧气反应4Fe2++O2+4H+= 4Fe3++2H2O,电路中转移1 mol电子,需消耗氧气0.25mol,即5.6L(标准状况)。
(4)由图可知, 阴极溶液为KOH,根据阳离子放电顺序H+>K+,即电解时阴极的电极反应式为2H++2e-= H2 ↑。阴极得到电子,阳离子向阴极移动,即电解过程中通过阳离子交换膜的离子主要为K+,其迁移方向是a→b。
归纳电极反应式的书写方法:原电池中先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失;注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。电解池中电极反应式的书写看阳极材料,如果阳极是惰性电极(Pt、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写。

【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
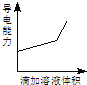
【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
A.AB.BC.CD.D