题目内容
【题目】硒是与硫同主族的元素。
已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
(1)通过以上反应判断SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是___。
工业上回收得到的SeO2样品混有其它杂质,可以通过下面的方法测定SeO2含量:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
(2)配平反应式①,标出电子转移的方向和数目___。
(3)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为___。
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(4)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是___溶液;各取5mL上述溶液,分别加热(温度相同),pH较小的是___溶液。
(5)取5mLNH4Cl溶液,加水稀释至50mL,c(H+)___10-6mol/L(填“>”、“<”或“=”),![]() ___填“增大”、“减小”或“不变”)。
___填“增大”、“减小”或“不变”)。
(6)向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸。
①在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为___(选填字母)。
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-) b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)] d.2c(Na+)=c(H2S)+c(HS-)+2c(S2-)
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是___(用离子方程式表示)。
【答案】H2SO4(浓)>SeO2>SO2 ![]() 92.5% H2SO4 NH4Cl > 减小 c Cu2++HS-=CuS↓+H+
92.5% H2SO4 NH4Cl > 减小 c Cu2++HS-=CuS↓+H+
【解析】
(1)Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O中Se元素化合价升高,S元素的化合价降低;2SO2+SeO2+2H2O→Se+2SO24+4H+中Se元素的化合价降低、S元素的化合价升高,由氧化剂的氧化性强于氧化产物的氧化性可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2,故答案为:H2SO4(浓)>SeO2>SO2;
(2)反应①中I-失去电子生成I2,共升高2价,SeO2中+4价Se得到电子还原为单质Se,共降低4价,化合价升降最小公倍数为4,故
KI的系数为4,I2的系数为2,SeO2、Se的系数都是1,KNO3的系数为4,H2O的系数为2,配平并标出电子转移的方向和数目为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)根据反应的方程式可知SeO22I24Na2S2O3,消耗的n(Na2S2O3)=0.2000mol/L×0.025L=0.005mol,根据关系式计算样品中n(SeO2)=0.005mol×14=0.00125mol,故SeO2的质量为0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数为
(0.13875g/0.1500g)×100%=92.5%,故答案为:92.5%;
(4)室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加水稀释至50mL,稀释10倍,硫酸溶液pH变化为6,促进氯化铵铵根离子水解,溶液中氢离子浓度减小的少,溶液pH小于6,则pH较大的是硫酸溶液;室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,各取5mL上述溶液,分别加热(温度相同),硫酸溶液中氢离子浓度变化不大,氯化铵溶液中水解是吸热热反应,加热促进水解,氢离子浓度增大,溶液pH较小的是NH4Cl氯化铵溶液;故答案为:H2SO4;NH4Cl;
(5)取5mLNH4Cl溶液,加水稀释至50mL,体积变化氢离子浓度减小10倍,稀释促进水解平衡,所以溶液中氢离子浓度大于106,但小于105;铵根离子水解平衡NH4++H2ONH3H2O+H+;稀释会促进水解,溶液中的铵根离子减小,氢离子增多,则![]() 减小,故答案为:>;减小;
减小,故答案为:>;减小;
(6)①向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,盐酸和氢氧化钠先反应,然后和硫化钠反应,含硫微粒浓度减小为S2,先增加后减少为HS,浓度一直在增加为H2S,向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸,因体积相同,设Na2S、NaOH各为1mol,则n(Na)=3n(S),溶液中含硫的微粒为HS、S2、H2S,则c(Na+)=3[c(H2S)+c(HS)+c(S2)],故答案为:c;
②恰好完全反应,所得溶液呈强酸性,则生成CuS和硫酸、硫酸钠,其离子反应方程式为:Cu2++HS=CuS↓+H+,故答案为:
Cu2++HS=CuS↓+H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
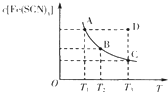
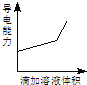
小学生10分钟应用题系列答案【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
A.AB.BC.CD.D