题目内容
1.将海水淡化与浓海水资源结合起来是综合利用海水的重要途径.(1)先把浓海水中溴离子氧化成Br2,再利用“空气吹出法”从浓海水中吹出Br2,用纯碱来吸收,Br2又变成化合态溴,这样做的目的是使Br2富集.利用纯碱吸收溴单质的主要反应式是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3则纯碱吸收了6molBr2时,转移的电子为10mol
(2)从浓海水中生产镁单质的一段工艺流程如图:
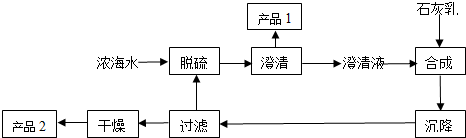
又知浓海水的主要成分如下表:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g/L) | 63.7 | 28.8 | 144.6 | 46.4 |
②1m3浓海水最多可得产品2的质量为69.60 kg.
(3)工业生产镁单质的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)从海水中提取出的氯化钠可用于氯碱工业,则氯碱工业主要反应原理的离子方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
分析 (1)吹出Br2,用SO2吸收,发生氧化还原反应生成硫酸和HBr,Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中Br由0降低为-1,由0升高为+5价,可知吸收3mol溴转移5mol电子;
(2)①工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁;
②计算1L溶液中Mg2+的质量,根据Mg2+~Mg(OH)2计算氢氧化镁的质量;
(3)电解熔融氯化镁得到Mg与氯气;
(4)从海水中提取出的氯化钠可用于氯碱工业,氯碱工业是电解饱和食盐水生成氢氧化钠溶液、氯气和氢气的反应.
解答 解:(1)吹出Br2,用SO2吸收,发生氧化还原反应生成硫酸和HBr,其目的是使Br2富集;Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3中Br由0降低为-1,由0升高为+5价,可知吸收3mol溴转移5mol电子,则吸收6mol Br2时,转移的电子为6mol×$\frac{5}{3}$=10mol,
故答案为:使Br2富集;10;
(2)①工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42-生成CaSO4沉淀,离子方程式为:Ca2++SO42-=CaSO4↓,采用过滤的方法得到产品1为CaSO4,含钙离子和硫酸根离子,滤液中加入石灰乳,发生反应为Mg2++2OH-=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,
故答案为:钙离子和硫酸根离子,Mg(OH)2,
②溶液中m(Mg2+)=1000L×28.8g/L=28800g,
Mg2+~Mg(OH)2
24g 58g
28800g m[Mg(OH)2]
m[Mg(OH)2]=28800g×$\frac{58}{24}$=69600g=69.60kg,
故答案为:Ca2++SO42-=CaSO4↓;Mg(OH)2;69.60;
(3)电解熔融氯化镁得到Mg与氯气,电解反应方程式为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(4)从海水中提取出的氯化钠可用于氯碱工业,则氯碱工业主要反应原理的离子方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
点评 本题考查了海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案| A. | K[Ag(CN)2]、[Cu(NH3)4]SO4 | B. | [Ag(NH3)2]Cl、K[Ag(CN)2] | ||
| C. | [Ag(NH3)2]Cl、[Cu(NH3)4]SO4 | D. | [Ni(NH3)4]Cl2、[Ag(NH3)2]Cl |
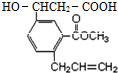 某有机物的结构简式如图所示,该有机物可能发生的反应是( )
某有机物的结构简式如图所示,该有机物可能发生的反应是( )①酯化反应;②银镜反应;③加成反应;④取代反应;⑤氧化反应;⑥加聚反应;⑦缩聚反应;⑧水解反应.
| A. | ①③④⑤⑥⑦⑧ | B. | ①②③④⑤⑥⑧ | C. | ①②③⑥⑧ | D. | ①③④⑤⑥⑧ |
| A. | SiO2 是酸性氧化物,能与氢氟酸反应 | |
| B. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| A. | 铝合金是目前用量最大、用途最广的合金 | |
| B. | 二氧化硫使品红溶液褪色和使溴水褪色的原理相同 | |
| C. | 三种分散系中,胶体的稳定性介于溶液和浊液之间,属于介稳体系 | |
| D. | 活泼金属在空气中易与氧气反应,表面生成一层氧化物,对内部金属都能起保护作用 |
| A. | 钇在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | 质子数与中子数之差为50 | |
| D. | 89Y和90Y是两种不同的核素 |
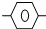 CH2-CH=CHCH3的说法正确的是( )
CH2-CH=CHCH3的说法正确的是( )| A. | 所有C原子可能共平面 | B. | 除苯环外的C原子共直线 | ||
| C. | 最多只有10个C共平面 | D. | 最多只有4个C共直线 |

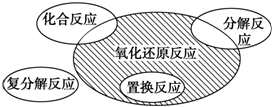 氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题:
氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题: =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O