题目内容
13.下列说法正确的是( )| A. | 铝合金是目前用量最大、用途最广的合金 | |
| B. | 二氧化硫使品红溶液褪色和使溴水褪色的原理相同 | |
| C. | 三种分散系中,胶体的稳定性介于溶液和浊液之间,属于介稳体系 | |
| D. | 活泼金属在空气中易与氧气反应,表面生成一层氧化物,对内部金属都能起保护作用 |
分析 A.目前世界上用量最大的合金是铁合金;
B.二氧化硫有还原性;
C.胶体粒子直径在1-100nm之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm;
D.氧化钠是疏松的.
解答 解:A.目前世界上用量最大的合金是铁合金,即钢材,故A错误;
B.二氧化硫使品红褪色,是因为二氧化硫能够与有色物质化合成无色物质,具有漂白性;二氧化硫有还原性,能与溴水发生氧化还原反应,故B错误;
C.胶体粒子直径在1-100nm之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm,分散质直径越大,越不稳定,所以胶体是介于溶液和浊液之间的在一定条件下能稳定存在的介稳体系,故C正确;
D.氧化钠是疏松的,不能保护内部的金属,故D错误.
故选C.
点评 本题主要考查金属的性质和用途、二氧化硫的化学性质以及分散系等,侧重考查了铝合金,解答时要充分理解各种物质的性质,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
3.对化学反应限度的叙述中错误的是( )
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应达到限度时,正、逆反应速率相等 | |
| C. | 化学反应的限度与时间的长短无关 | |
| D. | 改变外界条件,化学反应的限度不可能改变 |
4.相同温度和压强下,在容积为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),达到平衡状态的标志是( )
| A. | 颜色保持不变 | |
| B. | 气体密度保持不变 | |
| C. | 2v正(HI)=v逆(I2) | |
| D. | 拆开2 mol H-I共价键,同时生成1 mol H-H共价键 |
1.将海水淡化与浓海水资源结合起来是综合利用海水的重要途径.
(1)先把浓海水中溴离子氧化成Br2,再利用“空气吹出法”从浓海水中吹出Br2,用纯碱来吸收,Br2又变成化合态溴,这样做的目的是使Br2富集.利用纯碱吸收溴单质的主要反应式是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3则纯碱吸收了6molBr2时,转移的电子为10mol
(2)从浓海水中生产镁单质的一段工艺流程如图:
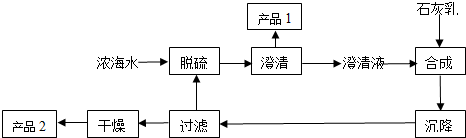
又知浓海水的主要成分如下表:
①该工艺过程中,产品1中一定含有的离子是钙离子和硫酸根离子,产品2的化学式为Mg(OH)2.
②1m3浓海水最多可得产品2的质量为69.60 kg.
(3)工业生产镁单质的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)从海水中提取出的氯化钠可用于氯碱工业,则氯碱工业主要反应原理的离子方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
(1)先把浓海水中溴离子氧化成Br2,再利用“空气吹出法”从浓海水中吹出Br2,用纯碱来吸收,Br2又变成化合态溴,这样做的目的是使Br2富集.利用纯碱吸收溴单质的主要反应式是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3则纯碱吸收了6molBr2时,转移的电子为10mol
(2)从浓海水中生产镁单质的一段工艺流程如图:

又知浓海水的主要成分如下表:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g/L) | 63.7 | 28.8 | 144.6 | 46.4 |
②1m3浓海水最多可得产品2的质量为69.60 kg.
(3)工业生产镁单质的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)从海水中提取出的氯化钠可用于氯碱工业,则氯碱工业主要反应原理的离子方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
8.有机物丁香油酚的结构式为: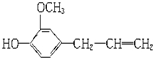 按官能团分类,它不具有哪类物质的性质( )
按官能团分类,它不具有哪类物质的性质( )
 按官能团分类,它不具有哪类物质的性质( )
按官能团分类,它不具有哪类物质的性质( )| A. | 酯 | B. | 酚 | C. | 醚 | D. | 烯烃 |
18.以下各条件的改变可确认发生了化学平衡移动的是( )
| A. | 由于温度的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 | |
| C. | 化学反应速率发生了改变 | |
| D. | 可逆反应达到平衡后,加入了催化剂 |
5.人类肝脏蛋白质两谱三图三库将于2010年全面破译完成,它将为肝脏疾病的预警、预防、诊断和治疗提供科学依据.下列关于乙肝病毒的说法不正确的是( )
| A. | 属于高分子化合物 | B. | 水解的最终产物能与酸或碱反应 | ||
| C. | 遇浓硝酸会变性 | D. | 水解时碳氧键断裂 |
2.请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及分离方法的编号填入表中.
试剂:a.H2O b.酸性KMnO4溶液 c.Br2的CCl4溶液 d.饱和Na2CO3溶液 e.新制CaO
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 E.盐析
试剂:a.H2O b.酸性KMnO4溶液 c.Br2的CCl4溶液 d.饱和Na2CO3溶液 e.新制CaO
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 E.盐析
| 混合物 | 选择试剂 | 分离方法 |
| 二氧化硫(乙烯) | c | C |
| 乙醇(水) | e | D |
| 乙酸乙酯(乙酸) | d | A |
3.某混合溶液中含SO42-0.25mol/L,含Cl-0.5mol/L,NO3-0.25mol/L,含Na+0.25mol/L,其余为H+,则H+的物质的量浓度为( )
| A. | 5mol/L | B. | 2.5mol/L | C. | 1mol/L | D. | 0.1mol/L |