题目内容
9. 氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题:
氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题:(1 )在发生离子反应的反应物或生成物中,一定存在③⑤.
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
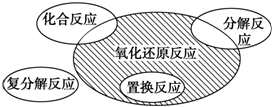
(2)氧化还原反应与四种基本类型反应的关系如图所示
请写出一个属于图中阴影部分的化学反应方程式2Na2O2+2CO2═2Na2CO3+O2
Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2
Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
SO2+Cl2+2H2O=H2SO4+2HCl
C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O
3NO2+H2O=2HNO3+NO、
2 NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3 H2O
C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+4NO2↑+2H2O
任意一个.
( 3 )离子方程式是重要的化学用语.有的离子方程式不仅可表示一个反应,还可表示一类反应.
下列离子方程式中,只能表示一个化学反应的是③ (填编号)
①Fe+Cu2+═Fe2++Cu
②Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
③Cl2+H2O═H++Cl-+HClO
④CO32-+2H+═CO2↑+H2O
⑤Ag++Cl-═AgCl↓
( 4 )某一反应体系中有反应物和生成物共五种:O2、H2CrO4、Cr(OH)3、H2O、H2O2.
已知该反应中H2O2只发生如下过程:H2O2-→O2.
①写出该反应的化学方程式,并标出电子转移的方向和数目.
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O②如反应中转移了0.3mol电子,则产生的气体在标准状况下体积为3.36L.
分析 (1)离子反应是由离子参加的反应,化合物在一定的条件下电离出能反应的离子;
(2)由图可知,该氧化还原反应不属于四种基本类型,据此书写;
(3)①Fe+Cu2+═Fe2++Cu表示铁与可溶性铜盐反应;
②Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O表示氢氧化钡与可溶性硫酸氢盐或者硫酸反应;
③Cl2+H2O═H++Cl-+HClO表示氯气与水反应;
④CO32-+2H+═CO2↑+H2O表示强酸与可溶性碳酸盐反应;
⑤Ag++Cl-═AgCl↓表示硝酸银与可溶性盐酸盐反应;
(4)①由失去电子的元素指向得到电子的元素,并标出电子转移的总数来用单线桥法标出电子转移的方向和数目;
②由反应可知生成3mol气体转移6mol电子,以此来计算.
解答 解:(1)离子反应是由离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,
故答案为:③⑤;
(2)由图可知,该氧化还原反应不属于四种基本类型,则常见的符合条件的反应为2Na2O2+2CO2═2Na2CO3+O2
Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2
Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
SO2+Cl2+2H2O=H2SO4+2HCl
C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O
3NO2+H2O=2HNO3+NO、
2 NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3 H2O
C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+4NO2↑+2H2O
故答案为:2Na2O2+2CO2═2Na2CO3+O2
Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2
Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
SO2+Cl2+2H2O=H2SO4+2HCl
C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O
3NO2+H2O=2HNO3+NO、
2 NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3 H2O
C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+4NO2↑+2H2O任意一个;
(3)①Fe+Cu2+═Fe2++Cu表示铁与可溶性铜盐反应,表示一类反应,故错误;
②Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O表示氢氧化钡与可溶性硫酸氢盐或者硫酸反应,表示一类反应,故错误;
③Cl2+H2O═H++Cl-+HClO表示氯气与水反应,表示一个反应,故正确;
④CO32-+2H+═CO2↑+H2O表示强酸与可溶性碳酸盐反应,表示一类反应,故错误;
⑤Ag++Cl-═AgCl↓表示硝酸银与可溶性盐酸盐反应,表示一类反应,故错误
故选:③;
(4)①该反应中O元素失电子,Cr元素得到电子,2molH2CrO4反应转移电子为2mol×(6-3)=6mol,则用单线桥法标出电子转移的方向和数目为 =2Cr(OH)3↓+3O2↑+2H2O,
=2Cr(OH)3↓+3O2↑+2H2O,
故答案为: =2Cr(OH)3↓+3O2↑+2H2O;
=2Cr(OH)3↓+3O2↑+2H2O;
②由2H2CrO4+3H2O2═2Cr(OH)3↓+3O2↑+2H2O可知,生成3mol气体转移6mol电子,则转移了0.3mol电子,则产生的气体的物质的量为$\frac{0.3}{6}$mol=0.15mol,
其在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L.
点评 本题考查氧化还原反应、离子反应和反应之间的相互关系的考查,明确过氧化氢发生的反应及氧化还原反应中既有元素的化合价升高又有元素的化合价降低来分析是解答的关键,然后利用化合价变化来计算电子的转移即可.

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案| A. | 肥皂中含有甘油(氯化钠、盐析) | B. | 乙醇中含有水(氧化钙、蒸馏) | ||
| C. | 溴苯含有溴(氢氧化钠溶液、分液) | D. | 苯中含有苯酚(浓溴水,过滤) |
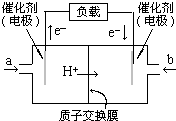 燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )
燃料电池是一种很有发展前景的电池,甲醇燃料电池的结构如图.丁烷在催化剂作用下提供质子(H+)和电子.电子经外电路、质子经内电路到达另一极与氧气反应.电池总反应式为:2C4H10+13O2═8CO2+10H2O.下列说法中正确的是( )| A. | 右边的电极为电池的负极,b处通入的是空气 | |
| B. | 左边的电极为电池的负极,a处通入的是空气 | |
| C. | 电池负极的反应式为:2C4H10+16H2O-52e-═8CO2+52H+ | |
| D. | 电池的正极反应式为:13O2+26H2O+52e-═4OH- |
| A. | 颜色保持不变 | |
| B. | 气体密度保持不变 | |
| C. | 2v正(HI)=v逆(I2) | |
| D. | 拆开2 mol H-I共价键,同时生成1 mol H-H共价键 |
(1)先把浓海水中溴离子氧化成Br2,再利用“空气吹出法”从浓海水中吹出Br2,用纯碱来吸收,Br2又变成化合态溴,这样做的目的是使Br2富集.利用纯碱吸收溴单质的主要反应式是:Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3则纯碱吸收了6molBr2时,转移的电子为10mol
(2)从浓海水中生产镁单质的一段工艺流程如图:
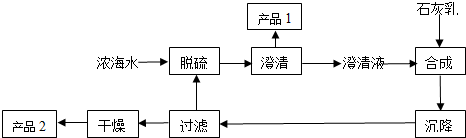
又知浓海水的主要成分如下表:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g/L) | 63.7 | 28.8 | 144.6 | 46.4 |
②1m3浓海水最多可得产品2的质量为69.60 kg.
(3)工业生产镁单质的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(4)从海水中提取出的氯化钠可用于氯碱工业,则氯碱工业主要反应原理的离子方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
| A. | 由于温度的改变,使平衡混合物中各组分的浓度发生了不同程度的改变 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变了压强 | |
| C. | 化学反应速率发生了改变 | |
| D. | 可逆反应达到平衡后,加入了催化剂 |
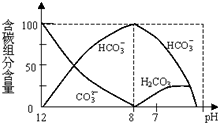 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.