题目内容
15.取两份一定质量的铝粉,将第一份铝粉加入足量的浓烧碱液;将第二份铝粉加入足量的盐酸,反应后得到的H2的质量相同,则两份铝粉的质量比为( )| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:2 |
分析 Al能和NaOH、HCl反应生成盐和氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Al+6HCl=2AlCl3+3H2↑,HCl、NaOH足量,所以根据Al和氢气之间的关系式计算即可.
解答 解:Al能和NaOH、HCl反应生成盐和氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Al+6HCl=2AlCl3+3H2↑,HCl、NaOH足量,根据方程式知,Al与生成氢气的量之间的关系式相同,生成氢气的质量相等,则消耗铝的质量相等,故选A.
点评 本题考查化学方程式的有关计算,正确书写方程式是解本题关键,根据物质之间的关系式解答,还可以根据转移电子守恒计算,题目难度不大.

练习册系列答案
相关题目
13.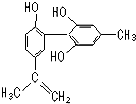 坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入KMnO4(H+)溶液,观察紫色变浅,是因为结构中存在碳碳双键 | |
| D. | 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol |
6.下列说法错误的是( )
| A. | 钠和铁一样,都能在氯气中燃烧生成金属氯化物 | |
| B. | 氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸 | |
| C. | 氯气跟变价金属反应生成高价金属氯化物 | |
| D. | 液氯是氯气的水溶液,它能使干燥的有色布条褪色 |
3.现有下列各项关于不同状态的物质属性的描述:
①构成微粒间有较大空隙;
②构成微粒可以自由移动;
③没有固定形状;
④不易被压缩.
某物质具备下列哪种组合的属性能够判断该物质为液体( )
①构成微粒间有较大空隙;
②构成微粒可以自由移动;
③没有固定形状;
④不易被压缩.
某物质具备下列哪种组合的属性能够判断该物质为液体( )
| A. | ①和④ | B. | ②和③ | C. | ①和③ | D. | ②和④ |
10.称量NaOH固体的质量时,不能把它放在纸上称量而是放在已知质量的烧杯中进行称量的主要原因是( )
| A. | 因为放在烧杯中称量比放在纸上称量更准确 | |
| B. | 因为配制溶液是在烧杯中进行,直接放在烧杯中称量会减少操作过程 | |
| C. | 因NaOH易潮解且有强腐蚀性 | |
| D. | 因为放在纸上称量会混有杂质,降低所配制溶液的纯度 |
7.1L 2mol/L NaOH溶液中取出0.6L,剩下的溶液的浓度为( )
| A. | 2mol/L | B. | 1.2mol/L | C. | 0.8mol/L | D. | 无法确定 |
4.在由水电离产生的c(H+)=1×10-14mol•L-1的某无色溶液中一定能大量共存的是( )
| A. | Fe2+.K+.SO42-.NO3- | B. | Mg2+.NH4+.SO42-.C1- | ||
| C. | Na+.K+.SO42-.NO3- | D. | Ba2+.Na+.SO42-.MnO4- |