题目内容
8.下列排列顺序正确的是( )| A. | 微粒半径:Na+>K+>Cl->S2- | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO4 | D. | 熔点:Al>Mg>Na>K |
分析 A、电子层数越多半径越大,核外电子排布相同的离子,离子核电荷数越大,半径越小;
B、元素的非金属性越强,对应的氢化物越稳定;
C、元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D、金属晶体中金属阳离子所带电荷越多,半径越小,金属键越强,熔点越高.
解答 解:A、K+、Cl-、S2-三个电子层,而钠离子二个电子层,所以微粒半径:Na+<K+<Cl-<S2-,故A错误;
B、元素的非金属性:F>Cl>Br>I,所以稳定性:HI<HBr<HCl<HF,故B错误;
C、元素的非金属性:Cl>S>P>Si,所以酸性:HClO4>H2SO4>H3PO4>H2SiO4,故C正确;
D、金属晶体中金属阳离子所带电荷越多,半径越小,金属键越强,熔点越高,所以熔点:Al>Mg>Na>K,故D正确;
故选CD.
点评 本题考查非金属性、金属性及熔点的比较,把握元素的位置与性质的关系、元素周期律为解答的关键,注意规律性知识的归纳和应用,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
18.下列粒子的结构示意图中,表示钠离子( )
| A. | 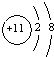 | B. | 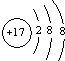 | C. | 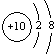 | D. | 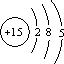 |
19.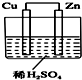 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
实验后的记录:
①Cu为负极,Zn为正极 ②Cu极上发生还原反应
③SO2−42−4向Zn极移动 ④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu-→Zn ⑥正极反应式:Cu+2e-═Cu2+,发生氧化反应.
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )实验后的记录:
①Cu为负极,Zn为正极 ②Cu极上发生还原反应
③SO2−42−4向Zn极移动 ④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu-→Zn ⑥正极反应式:Cu+2e-═Cu2+,发生氧化反应.
| A. | ①②⑥ | B. | ②③④ | C. | ②③⑥ | D. | ③④⑤ |
3.铁是一种应用广泛的金属.下列有关铁的说法错误的是( )
| A. | 铁在氧气中燃烧生成四氧化三铁 | B. | 常温下,铁在浓硫酸中会发生钝化 | ||
| C. | 铁与盐酸反应生成氯化铁与氢气 | D. | 铁是一种银白色金属 |
13.下列离子方程式,正确的是( )
| A. | 过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 澄清石灰水中通入过量二氧化碳:OH-+CO2═HCO3- | |
| C. | 往FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |
17.2-甲基丁烷跟氯气发生取代反应,可能得到一氯代物,该一氯代物水解后可得到( )种醇.
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
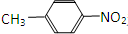 和
和 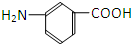

 .
.