题目内容
【题目】在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2(g)![]() N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
N2O4(g)ΔH < 0,将容器置于100 ℃的水浴中,则下列性质不改变的是
A.颜色B.压强C.质量D.平均相对分子质量
【答案】C
【解析】
A选项,升高温度,化学平衡向左移动,二氧化氮的浓度增大,颜色加深,故A错误;
B选项,升高温度,化学平衡向左移动,混合气体总的物质的量增大且温度升高,容器的容积不变,根据PV=nRT可知,容器内压强增大,故B错误;
C选项,反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变,故C正确;
D选项,升高温度,化学平衡向左移动,混合气体总的物质的量增大,混合气体总的质量不变,根据M = m/n可知,混合气体的平均相对分子质量减小,故D错误。
综上所述,答案为C。

【题目】诺贝尔化学奖获得者乔治·欧拉教授率领团队首次采用金属钌作催化剂,从空气中捕获CO2直接转化为甲醇,为通往未来“甲醇经济”迈出了重要一步,并依据该原理开发如图所示转化。
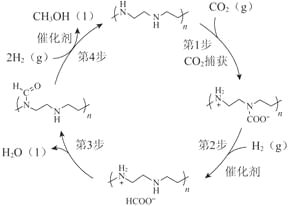
(1)CO2中含有的化学键类型是_________键。
(2)将生成的甲醇(沸点为64.7℃)与水分离可采取的方法是_________。
(3)上图所示转化中,由第1步至第4步的反应热(ΔH)依次是a kJ/mol、b kJ/mol、c kJ/mol、d kJ/mol,则该转化总反应的热化学方程式是_________。
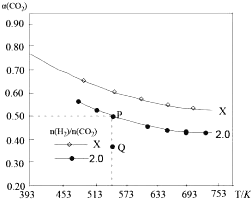
(4)500℃时,利用金属钌做催化剂,在固定容积的密闭容器中可直接实现如(3)中转化得到甲醇。测得该反应体系中X、Y浓度随时间变化如图。
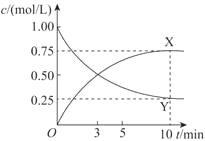
①Y的化学式是_________,判断的理由是_________。
②下列说法正确的是_________(选填字母)。
A.Y的转化率是75% |
B.其他条件不变时,若在恒压条件下进行该反应,Y的转化率高于75% |
C.升高温度使该反应的平衡常数K增大,则可知该反应为吸热反应 |
D.金属钌可大大提高该反应中反应物的转化率 |
③从反应开始到平衡,用氢气表示的平均反应速率v(H2) =_________mol/(L·min)。
【题目】t ℃时,在容积不变的密闭容器中发生反应X(g)+3Y(g) ![]() 2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表所示,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min时浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.平衡后,增大体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1