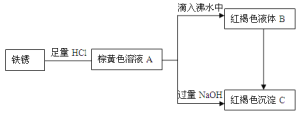
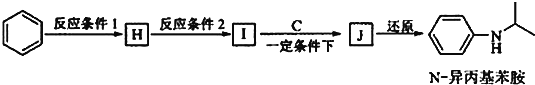
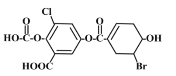
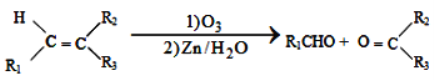题目内容
【题目】常温时,1mol·L-1的CH3NH2和1mol·L-1的NH2OH(NH2OH+H2O![]() NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法正确的是
NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法正确的是

A. NH2OH的电离常数K的数量级为10-8
B. CH3NH3Cl盐溶液中水解离子方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 当两溶液均稀释至lg![]() =4时,溶液中水的电离程度:NH2OH >CH3NH2
=4时,溶液中水的电离程度:NH2OH >CH3NH2
D. 浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:c(CH3NH3+)<c(NH3OH+)
【答案】C
【解析】
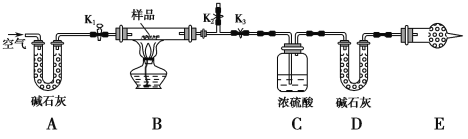
A.根据NH2OH+H2ONH3OH++OHˉ,1molL-1的NH2OH的pOH值为4.5,即有c(OH-)=c(NH3OH+)=10-4.5,电离程度小,c(NH2OH)≈1mol/L,故平衡常数K=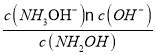 =
=![]() =10-9,故数量级为10-9,故A错误;
=10-9,故数量级为10-9,故A错误;
B.弱碱阳离子水解,生成相应的弱碱和氢离子,所以CH3NH3+水解方程式为:CH3NH3++H2O![]() CH3NH2+H3O+,故B错误;
CH3NH2+H3O+,故B错误;
C.碱溶液抑制水的电离,碱性越强,水的电离越弱,当两溶液均稀释至lg![]() =4时,CH3NH2的pOH值较小,即碱性较强,溶液中水的电离程度:NH2OH>CH3NH2,故C正确;
=4时,CH3NH2的pOH值较小,即碱性较强,溶液中水的电离程度:NH2OH>CH3NH2,故C正确;
D.1molL-1的CH3NH2比1molL-1的NH2OH的pOH值小,即碱性强,根据水解规律,越弱越水解,NH3OH+的水解程度大,所以浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:(NH3OH+)<c(CH3NH3+),故D错误;
故答案为C。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:
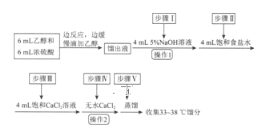

物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为_____________。
(3)仪器D中盛有冰水混合物,其作用为____________。
(4)操作1的名称为_______________。
(5)若省略步骤Ⅱ会导致的后果是________。