题目内容
【题目】实验室需要0.80 mol·L-1NaOH溶液480 mL和0.40 mol·L-1硫酸500 mL。根据这两种
溶液的配制情况回答下列问题:
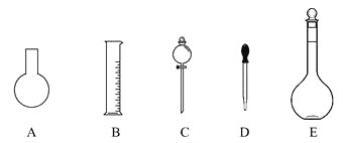
(1)如图所示的仪器中配制溶液肯定不需要的是_____(填字母),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)根据计算用托盘天平称取NaOH的质量为__g,应放在_________(填仪器名称)称量。
(3)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为
______mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL的量筒,应选用____mL的量筒最好。
(4)下列操作会引起所配溶液浓度偏大的是____(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.向容量瓶中转移时,有少量液体溅出
C.定容时仰视刻度线
D.定容后倒置摇匀后再正立时,发现液面低于刻度线
(5)温度计、量筒、滴定管的一部分如图所示,下述读数 (虚线所指刻度)及说法正确的是____(填字母)。
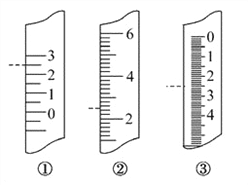
A.①是量筒,读数为2.5 mL B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL D.①是温度计,读数为2.5℃
【答案】 A C 500mL容量瓶和玻璃棒 16.0 小烧杯 10.9 15 A BD
【解析】(1)配制一定物质的量浓度的溶液,步骤有:计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀。肯定不需要烧瓶和分液漏斗,配制上述溶液还需用到的玻璃仪器有500mL容量瓶和玻璃棒,故答案为:AC;500mL容量瓶和玻璃棒;
(2)NaOH的质量为0.5L×0.8mol/L×40g/mol=16.0g,氢氧化钠具有腐蚀性,应该用小烧杯称量,故答案为:16.0;小烧杯;
(3)质量分数为98%、密度为1.84 g·cm-3的浓硫酸的物质的量浓度c=![]() =
=![]() =18.4mol/L,体积为
=18.4mol/L,体积为![]() =0.0109L=10.9mL,可以选用15 mL的量筒量取,故答案为:10.9;15;
=0.0109L=10.9mL,可以选用15 mL的量筒量取,故答案为:10.9;15;
(4)A.用量筒量取浓硫酸时,仰视量筒的刻度,单质量取的浓硫酸体积偏大,则浓度偏大,正确;B.向容量瓶中转移时,有少量液体溅出,导致溶质的物质的量偏小,浓度偏小,错误;C.定容时仰视刻度线,导致溶液的体积偏大,浓度偏小,错误;D.定容后倒置摇匀后再正立时,发现液面低于刻度线,对结果无影响,错误;故选A;
(5)A.量筒没有0刻度,故A错误;B.②是量筒,读数为2.5 mL,故B正确;C.滴定管的0刻度在上端,③是滴定管,读数为2.50 mL,故C错误;D.温度计的0刻度在中间,①是温度计,读数为2.5℃,故D正确;故选BD。

【题目】一定温度下,在三个体积均为2.0L 的恒容密闭容器中发生如下反应:A(g)B(g)+C(g) ΔH>0。
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | 达到平衡所需时间(s) | |
A(g) | B(g) | C(g) | |||
Ⅰ | T1 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | T2 | 0.80 | t2 | ||
Ⅲ | T3 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A. 达到平衡的时间:t3>t1
B. 反应达到平衡时,A的转化率:容器Ⅱ>容器I
C. 反应达到平衡时,容器I中的平均速率为v(A)=(0.10/t1)mol/(L·s)
D. T1时,该反应的平衡常数为1/60mol/L



