题目内容
【题目】下列有关物质性质与用途具有对应关系的是
A. Fe比Cu活泼,FeCl3溶液可用作铜制线路板的蚀刻剂
B. SiO2熔点高,可用作半导体材料
C. Ca(C1O)2具有氧化性,可用于消菌杀毒
D. CO2密度比空气大,可用作镁着火时的灭火剂
【答案】C
【解析】A、FeCl3溶液可用作铜制线路板的蚀刻剂,说明Fe3+的氧化性比Cu2+强,与Fe比Cu活泼无关,选项A错误; B、SiO2熔点高,但用作半导体材料的是硅单质,关系不对应,选项B错误;C、Ca(C1O)2具有氧化性,可用于消菌杀毒,正确且有对应关系,选项C正确;D、二氧化碳与镁反应生成氧化镁和碳,所以镁可以在二氧化碳中燃烧,选项D错误。答案选C。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:
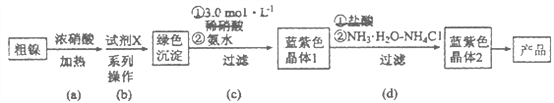
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
【题目】下物质分类组合正确的是 ( )
A | B | C | D | |
强电解质 | HCl | FeCl3 | H3PO4 | HClO |
弱电解质 | HF | CH3COOH | NH3·H2O | Ba(OH)2 |
非电解质 | C2H5OH | Zn | H2O | SO3 |
A. A B. B C. C D. D