题目内容
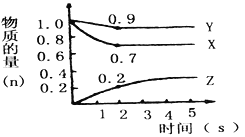
【题目】Ⅰ.某温度时,下图中曲线X、Y、Z是在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线。由图中数据分析:
① 该反应的化学方程式为__________________________;
② 反应开始至2s,Z的平均反应速率为______________。
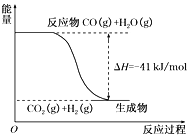
Ⅱ.①根据下列图示,写出反应的热化学方程式:___________________________________。
②已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是: ___________.
【答案】 3X + Y ![]() 2Z 0.05 mol·L-1·S-1 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ/mol S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ/mol
2Z 0.05 mol·L-1·S-1 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ/mol S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ/mol
【解析】Ⅰ.① 根据图像可知反应进行到2s时X和Y分别减少了0.3mol、0.1mol,Z增加了0.2mol,根据变化量之比是相应的化学计量数之比可知该反应的化学方程式为3X + Y ![]() 2Z;② 反应开始至2s,Z的平均反应速率为0.2mol/(2L·2s)=0.05mol/(L·s)。
2Z;② 反应开始至2s,Z的平均反应速率为0.2mol/(2L·2s)=0.05mol/(L·s)。
Ⅱ.①根据图像可知反应物总能量大于生成物总能量,是放热反应,反应热=-41kJ/mol,因此反应的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ/mol。②已知16 g固体硫完全燃烧时放出148.4 kJ的热量,因此1mol硫即32g硫完全燃烧放热是296.8 kJ,所以该反应的热化学方程式是S(s)+O2(g)=SO2(g) ΔH=-296.8 kJ/mol。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。