题目内容
4.已知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1.某H2和CO的混合气体完全燃烧时放出113.74KJ热量,同时生成3.6g液态水,则气体中H2和CO的物质的量之比为( )| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 2:3 |
分析 先根据生成水的质量,利用2H2+O2═2H2O(l)可计算氢气的物质的量,利用混合气体燃烧放出的热量与氢气燃烧放出的热量来计算CO燃烧放出的热量,再利用热化学反应方程式来计算CO的物质的量,最后求出物质的量之比.
解答 解:水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,由2H2+O2═2H2O可知,n(H2)=n(H2O)=0.2mol,由2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1可知0.2molH2燃烧放出的热量为57.16KJ,
则CO燃烧放出的热量为113.74KJ-57.16KJ=56.58KJ,
设混合气体中CO的物质的量为x,则
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1
1 283KJ
x 56.58KJ
$\frac{1}{x}$=$\frac{283}{56.58}$,解得x=0.2mol,即n(CO)=0.20mol,原混合气体中H2和CO的物质的量均为0.2mol,H2和CO的物质的量之比为1:1,
故选C.
点评 本题考查有关反应热的计算,明确物质的量与热量的正比例关系是解答的关键,题目难度不大,属于基础知识的考查.

练习册系列答案
相关题目
14.两种金属混合粉末15g,与足量的盐酸反应时,生成11.2L氢气(标准状况),符合上述的金属混合物是( )
| A. | Mg 和 Ag | B. | Mg和 Al | C. | Cu和 Zn | D. | Fe 和 Zn |
15.下列化学用语正确的是( )
| A. | H2O2的电子式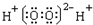 | |
| B. | 甲醛的结构简式:CH2O | |
| C. | N2的结构式::N≡N: | |
| D. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I |
12.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 0.1mol-NH2(氨基)中含有的电子数目为1.0NA | |
| B. | 常温下,1L 0.1mol•L-1 CH3COONa溶液中含有阴离子总数大于0.1NA | |
| C. | 标准状况下,2.24 LH2O中含有的原子总数大于0.3NA | |
| D. | 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
7.已知C5H11Br有8种同分异构体,则C6H12O2属于羧酸的结构有( )
| A. | 4种 | B. | 8种 | C. | 7种 | D. | 6种 |
8.下列物质中,含有极性共价键的离子化合物是( )
| A. | NaCl | B. | Cl2 | C. | HCl | D. | NaOH |
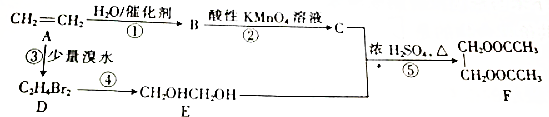
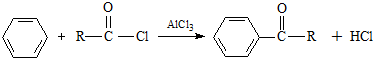
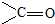 )的化合物反应生成醇:
)的化合物反应生成醇: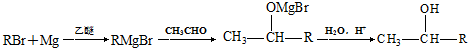
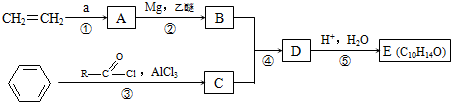
 ,F
,F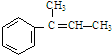 ,G
,G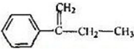 .
.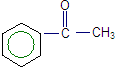 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$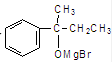 .
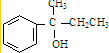
.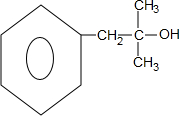 ;若E′与浓硫酸共热不能得到碳链不变的烯烃,则E′可能的结构简式为
;若E′与浓硫酸共热不能得到碳链不变的烯烃,则E′可能的结构简式为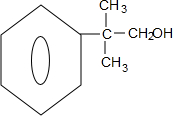 .
.