题目内容
20.阿伏加德罗常数为NA,下列说法正确的是( )| A. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| B. | 将含有0.1molFeCl3的饱和溶液滴入沸水中,产生胶粒的数目为0.1NA | |
| C. | 1molC7H16中含有共价键的数目为23NA | |
| D. | 常温下,1L 0.1 mol•L-1的Na2CO3溶液中含有的离子总数为0.3NA |
分析 A.钠与氧气无论生成过氧化钠还是氧化钠,化合价都是由0到+1价;
B.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶体中含有的胶粒数目;
C.1molC7H16中含有16molC-H键,含有6molC-C键;
D.碳酸钠溶液中碳酸根离子水解生成氢氧根离子,溶液中离子总数增大.
解答 解:A.钠与氧气反应生成Na2O或Na2O2时,钠元素都是从0升高到+1价,1mol钠失去1mol电子,失电子数目均为NA,故A正确;
B.氢氧化铁胶粒为氢氧化铁的聚集体,将含有0.1molFeCl3的饱和溶液滴入沸水中,产生胶粒的数目小于0.1NA,故B错误;
C.1molC7H16中含有16molC-H键,含有6molC-C键,含有共价键的数目为22NA,故C错误;
D.1L 0.1 mol•L-1的Na2CO3溶液中含有溶质碳酸钠0.1mol,碳酸根离子部分水解,溶液中阴离子数目增多,所以溶液中含有的离子总物质的量大于0.3mol,离子总数大于0.3NA,故D错误;
故选:A.
点评 本题考查了阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,胶体的性质、盐类的水解规律是解题关键,题目难度不大.

练习册系列答案
相关题目
10.下列各项中表达正确的是( )
| A. | F-的结构示意图: | B. | CO2的分子模型示意图: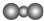 | ||
| C. | N2的结构式::N≡N: | D. | CSO的电子式: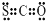 |
11.下列事实不能用勒沙特列原理解释的是( )
| A. | 氨水应密闭保存,放置低温处 | |
| B. | 在FeSO4溶液中,加入Fe粉以防止变质 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 实验室常用排饱和食盐水的方法收集Cl2 |
8.在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为1.2mol/L.若维持容器的体积和温度不变,只加入C和D作为起始物质,使反应从逆反应开始,达到平衡时,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的条件是( )
| A. | 大于零即可 | B. | 大于0.6mol | C. | 大于或等于1mol | D. | 任意值 |
15.下列化学用语正确的是( )
| A. | H2O2的电子式 | |
| B. | 甲醛的结构简式:CH2O | |
| C. | N2的结构式::N≡N: | |
| D. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I |
12.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 0.1mol-NH2(氨基)中含有的电子数目为1.0NA | |
| B. | 常温下,1L 0.1mol•L-1 CH3COONa溶液中含有阴离子总数大于0.1NA | |
| C. | 标准状况下,2.24 LH2O中含有的原子总数大于0.3NA | |
| D. | 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
4.下列说法正确的是( )


| A. | “辛烷值”可用来表示汽油的质量,异辛烷的爆震程度最小.图1是异辛烷的球棍模型,系统命名为2,4,4三甲基戊烷 | |
| B. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| C. | 乙酸乙酯中除去乙酸:用饱和碳酸钠溶液洗涤后分液 | |
| D. | 图2化合物核磁共振氢谱图中有5个吸收峰 |