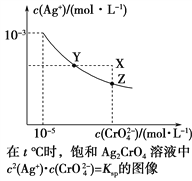
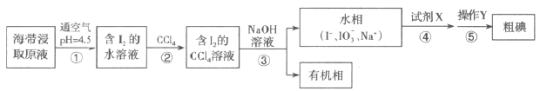
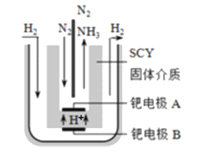
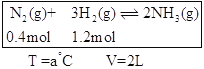题目内容
【题目】常温下,下列溶液中的离子浓度关系式正确的是
A.pH =2的H2C2O4(二元弱酸)溶液与pH=12的NaOH溶液任意比例混合:c(Na+) + c(H+)= c(OH-) + c(![]() )
)
B.pH = a的氨水溶液中,c(NH3·H2O) = 10-a mol/L
C.新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.pH相同的①CH3COONa,②NaHCO3,③NaClO三种溶液的c(Na+):①>②>③
【答案】D
【解析】
A.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合,溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故A错误;
B.一水合氨为弱电解质,pH = a的氨水溶液中,c(NH3·H2O) > 10-a mol/L,故B错误;
C.新制氯水中含有HCl和HClO,两种酸电离导致溶液呈酸性,其中HCl完全电离,HClO部分电离,但电离程度较小,溶液呈酸性,溶液中氢氧根离子浓度很小,所以离子浓度大小顺序是c(H+)>c(Cl-),故C错误;
D.等浓度时对应酸的酸性越弱,水解程度越大,溶液的pH越大,酸性醋酸>碳酸>HClO,则pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液,盐溶液的浓度为①>②>③,其c(Na+)为①>②>③,故D正确;
故选D。

【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。
I.请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为________。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为_________(填化学式);
(3)元素①、③形成的18电子化合物的电子式为______;
(4)元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式);
(5)元素⑤、⑧的最高价氧化物对应的水化物的水溶液反应的离子方程式为_________。
II.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(6)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是__(填物质化学式)。若电解液体积为2L(
(7)甲醛(HCHO)燃料电池的工作原理如下图所示。

①该电池工作时,b口通入的物质为________;
②该电池工作时,电子的流向为___________(填“从左到右”或“从右到左”);
③右侧电极的电极反应方程式为___________。