题目内容
9.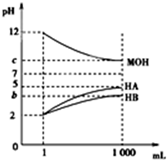 室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )
室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1 000mL,其pH的变化与溶液体积的关系如图,下列说法错误的是( )| A. | HA为强酸,HB为弱酸 | |
| B. | 若b+c=14,则MOH为弱碱 | |
| C. | 若c=9,则稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为HA>MOH>HB | |
| D. | 若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)=c(M+) |
分析 A.pH=a的强酸,稀释10n倍后,溶液的pH=a+n,pH=a的弱酸,稀释10n倍后,溶液的pH介于a和a+n之间.据此可确定;
B.已知b<5,根据b+c=14计算出MOH碱溶液的pH值,然后进行判断;
C.根据水的离子积Kw计算酸溶液中氢氧根浓度,酸溶液中水电离氢离子浓度等于水电离的氢氧根浓度.碱溶液中氢离子为水电离氢离子,根据碱溶液的pH值计算氢离子浓度,据此进行排序;
D.根据图可知HA为强酸,MOH为强碱.分别加水稀释到1000mL后,溶液中氢离子与氢氧根浓度相等.
解答 解:A.由图可知,pH═2的两种酸溶液HA,HB各1mL,分别加水稀释到1000mL后溶液HA的pH=5,增大3个单位,所以HA为强酸,溶液HB的pH值增大小于3个单位,HB所以为弱酸,故A正确;
B.若b+c=14,则b=14-c,在pH=c的MOH溶液中c(OH-)=10c-14 mol/L=10-b mol/L,已知b<5,吸热c(OH-)=10-2 mol/L的MOH稀释103倍后c(OH-)>10-5 mol/L,所以MOH是弱碱,故B正确;
C.pH=5的HA溶液中c(H+)水=c(OH-)水=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,所以水电离的氢离子浓度c(H+)水=10-9mol/L,
pH=b的HB溶液中c(H+)水=c(OH-)水=$\frac{1{0}^{-14}}{1{0}^{-b}}$mol/L=10-(14-b)mol/L,b<5,所以10-(14-b)mol/L<10-9mol/L,
pH=9的MOH溶液中,c(H+)水=1×10-9 mol/L,所以稀释后溶液中水电离的氢离子浓度顺序为:MOH=HA>HB,故C错误;
D.pH=12的MOH碱溶液1mL,加水稀释到1000mL后pH=9,pH降低3个单位,MOH为强碱;将稀释后的HA溶液和MOH溶液取等体积混合,二者恰好完全反应生成强酸强碱盐,溶液显中性,根据电荷守恒可知:c(A-)=c(M+),故D正确;
故选C.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度较大,注意明确pH=a的强酸,稀释10n倍后,溶液的pH=a+n,pH=a的弱酸,稀释10n倍后,溶液的pH介于a和a+n之间(若为碱则降低),试题侧重考查学生的分析、理解能力.

| A. | C2H4 | B. | C2H4O | C. | C2H6 | D. | C2H6O |
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) | |
| B. | 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L | |
| C. | 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| D. | 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
| A. | 逆反应速率一定增大 | B. | 平衡一定向正反应方向进行 | ||
| C. | 反应物的转化率一定增大 | D. | 该反应的条件一定发生变化 |
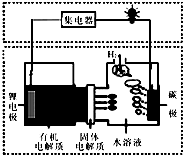
| A. | 碳极发生的反应是:2H2O+O2+4e-═4OH- | |
| B. | 有机电解质通过固体电解质可进入水溶液中 | |
| C. | 理论上,外电路中每转移1mol电子,负极消耗的质量为7g | |
| D. | 该电池如可以充电,充电时碳极接外加电源的负极,锂极接外加电池的正极 |
| A. | 谷氨酸的结构简式为: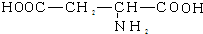 | |
| B. | 淀粉、纤维素在一定条件下都能水解生成葡萄糖 | |
| C. | 等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量相等 | |
| D. | 聚乳酸(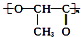 )是由单体之间通过加聚反应合成的 )是由单体之间通过加聚反应合成的 |
| A. | 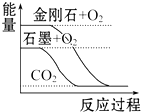 石墨转变为金刚石是吸热反应 | |
| B. | 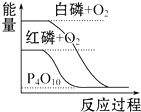 白磷比红磷稳定 | |
| C. | 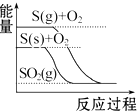 S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 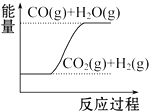 CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0 |
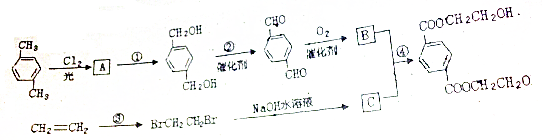
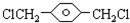 ,
,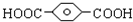 ,HOCH2CH2OH.
,HOCH2CH2OH.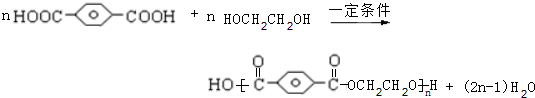 .
.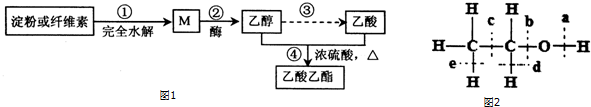
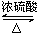 CH3 CH2CO18OCH2CH3+H2O.
CH3 CH2CO18OCH2CH3+H2O.