题目内容
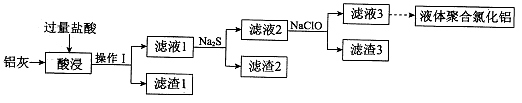
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
(1)Fe2O3 + 6H+ = 2Fe3+ + 3H2O (2分)
(2)稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液)(2分)
(3)①2Fe2+ + ClO- + 2H+ = 2Fe3+ +Cl- + H2O (2分)
②pH约为3时,Fe2+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀。 (2分)
(4)ClO- + Cl- + 2H+ = Cl2 + H2O (2分)
(5)浓缩至饱和,冷却结晶(2分)
(6)2 : 3 (1分)
(2)稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液)(2分)
(3)①2Fe2+ + ClO- + 2H+ = 2Fe3+ +Cl- + H2O (2分)
②pH约为3时,Fe2+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀。 (2分)
(4)ClO- + Cl- + 2H+ = Cl2 + H2O (2分)
(5)浓缩至饱和,冷却结晶(2分)
(6)2 : 3 (1分)
试题分析:(1)稀盐酸溶解Fe2O3:Fe2O3 + 6H+ = 2Fe3+ + 3H2O。
(2)验证FeO先要溶解,是盐酸,在证明Fe2+的检验,可用KMnO4溶液的褪色实验或K3[Fe(CN)6]溶液蓝色沉淀实验。
(3)①步骤Ⅱ中加入过量NaClO,将Fe2+氧化,2Fe2+ + ClO- + 2H+ = 2Fe3+ +Cl- + H2O。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是Fe2+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀。
(4)在步骤Ⅱ伴随着有氯气产生是因为:ClO- + Cl- + 2H+ = Cl2 + H2O。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是浓缩至饱和、冷却结晶。
(6)在步骤Ⅳ中发生反应,生成166 g Na2FeO4转移3 mol电子,3NaClO+4NaOH+2Fe(OH)3=2Na2FeO4+ 3NaCl + 5H2O。反应则参加反应的还原剂Fe(OH)3和氧化剂NaClO的物质的量之比是2:3。

练习册系列答案
相关题目
 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表: