题目内容
(15分)铜的氯化物是重要的化工原料,广泛地用作有机合成催化剂。
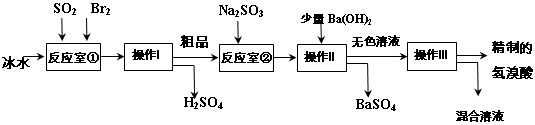
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。
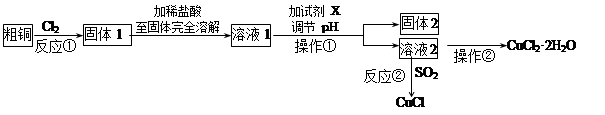
按要求回答下列问题:
(1)操作①的玻璃仪器有________________________,检验溶液2中是否含有杂质离子的操作是 。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ;
溶液1可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)___________。
a.NaHCO3 b.NH3·H2O c.CuO d.Cu2(OH)2CO3
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式: 。
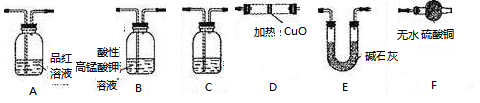
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。

①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验大试管加热前要进行一步重要操作,其操作是 。
②反应时,盛粗铜粉的试管中的现象是 。
实验室中以粗铜(含杂质Fe)为原料,某种制备铜的氯化物的流程如下。
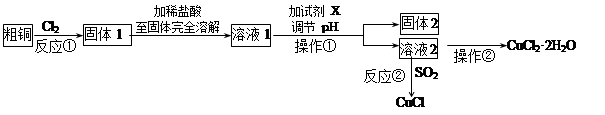
按要求回答下列问题:
(1)操作①的玻璃仪器有________________________,检验溶液2中是否含有杂质离子的操作是 。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ;
溶液1可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)___________。
a.NaHCO3 b.NH3·H2O c.CuO d.Cu2(OH)2CO3
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式: 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。

①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验大试管加热前要进行一步重要操作,其操作是 。
②反应时,盛粗铜粉的试管中的现象是 。
(1)(3分,各1分)漏斗、烧杯、玻璃棒;取适量的溶液于试管中,加入几滴KSCN溶液,观察溶液是否变红色(2分)。
(2)抑制氯化铜、氯化铁水解(1分); cd(2分)
(3)2Cu2++2Cl-+SO2+2H2O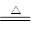 2CuCl↓+4H++SO42- (2分)
2CuCl↓+4H++SO42- (2分)
(4)①dejhfgb(2分); 先通入氯气,用氯气赶走装置中的空气,当装置中都出现黄绿色之后再加热大试管(2分)
②产生大量棕黄色烟(1分)
(2)抑制氯化铜、氯化铁水解(1分); cd(2分)
(3)2Cu2++2Cl-+SO2+2H2O
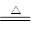 2CuCl↓+4H++SO42- (2分)
2CuCl↓+4H++SO42- (2分)(4)①dejhfgb(2分); 先通入氯气,用氯气赶走装置中的空气,当装置中都出现黄绿色之后再加热大试管(2分)
②产生大量棕黄色烟(1分)
试题分析:(1)操作①是过滤,玻璃仪器有漏斗、烧杯、玻璃棒;溶液2中若含有杂质离子则是Fe3+,检验溶液2中是否含有杂质离子Fe3+,取适量的溶液于试管中,加入几滴KSCN溶液,观察溶液是否变红色。
(2)氯化铜、氯化铁中的金属离子易水解,加入过量的酸可以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)2CO3。
(3)根据信息写反应:2Cu2++2Cl-+SO2+2H2O
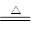 2CuCl↓+4H++SO42- ;
2CuCl↓+4H++SO42- ;(4)①Cl2发生装置→除去HCl气体装置→干燥装置→制备装置→多余Cl2处理装置。即dejhfgb;实验大试管加热前要进行一步重要操作,先通入氯气,用氯气赶走装置中的空气,当装置中都出现黄绿色之后再加热大试管;②Cu与Cl2反应产生大量棕黄色烟(CuCl2)。

练习册系列答案
相关题目