题目内容
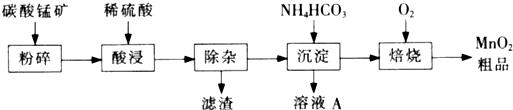
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是 。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+、A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 。 ②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去 。
(3)从溶液A中回收的主要物质是 ,该物质常用作化肥。(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2,写出Mn3O4与稀硫酸反应的化学方程式 。
 有关氢氧化物开始沉淀和沉淀完全的pH如下表:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:| 氢氧化物 | Al(OH)2 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请问答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是 。
(2)酸浸后的溶液中含有Mn2+、 SO42-,另含有少量Fe2+、Fe3+、A13+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其离子反应方程式为 。 ②加入CaO将溶液的pH调到5.2~6.0,其主要目的是 。
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去 。
(3)从溶液A中回收的主要物质是 ,该物质常用作化肥。(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2,写出Mn3O4与稀硫酸反应的化学方程式 。
(1)增大接触面积,加快反应速率(使反应更充分)
(2)①2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
②除去Fe3+,A13+
③Ca2+
(3)(NH4)2SO4
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O
(2)①2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
②除去Fe3+,A13+
③Ca2+
(3)(NH4)2SO4
(4)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O
(1)将反应物粉碎的作用是增大接触面积,加快反应速率,使反应更充分;
(2)pH调到5.2~6.0,其主要目的是除去Fe3+、A13+和部分Cu2+;
③溶液中除去Fe2+、Fe3+、A13+、Cu2+、Pb2+,但第②加入了Ca2+,再加入NaF溶液,显然是除去Ca2+;
(3)流程得到的是碳酸锰沉淀,溶液中主要剩余NH4+和SO42-,故回收的物质是(NH4)2SO4。
(4)由MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,可知反应物为Mn3O4和稀硫酸,生成物为MnSO4和MnO2,反应方程式可写成:Mn3O4+H2SO4→MnSO4+MnO2,根据原子守恒,还应有水生成,故可写出:Mn3O4+H2SO4→MnSO4+MnO2+H2O,利用化合价法和原子守恒配平方程式得:Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O
(2)pH调到5.2~6.0,其主要目的是除去Fe3+、A13+和部分Cu2+;
③溶液中除去Fe2+、Fe3+、A13+、Cu2+、Pb2+,但第②加入了Ca2+,再加入NaF溶液,显然是除去Ca2+;
(3)流程得到的是碳酸锰沉淀,溶液中主要剩余NH4+和SO42-,故回收的物质是(NH4)2SO4。
(4)由MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,可知反应物为Mn3O4和稀硫酸,生成物为MnSO4和MnO2,反应方程式可写成:Mn3O4+H2SO4→MnSO4+MnO2,根据原子守恒,还应有水生成,故可写出:Mn3O4+H2SO4→MnSO4+MnO2+H2O,利用化合价法和原子守恒配平方程式得:Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
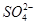
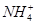
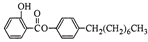 )如下:
)如下: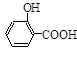 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→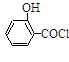 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑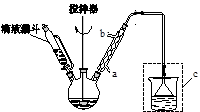
 ),温度控制在100℃左右,不断搅拌。
),温度控制在100℃左右,不断搅拌。