题目内容
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是________________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32- + CH3COOH = CH3COO- + CO2 ↑ + H2O
B.ClO- + CH3COOH = CH3COO- + HClO
C.CO32- + HClO = CO2 ↑ + H2O + ClO-
D.2 ClO- + CO2 + H2O = CO32-+ 2 HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是__________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
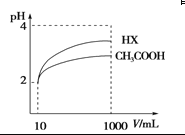
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化 如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
【答案】
(1)a、b、d、c
(2)c、d
(3)B
(4)大于 大于
【解析】
试题分析:(1)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c。
故答案为:a>b>d>c;
(2)a.CO32-+CH3COOH═CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;b.ClO-+CH3COOH═CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;c.CO32-+HClO═CO2↑+H2O+ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;d.2ClO-+CO2+H2O═CO32-+2HClO:由于酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;
故答案为:cd;
(3)A.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以![]() 的比值减小,故A错误;B.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则
的比值减小,故A错误;B.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则![]() 的比值增大,故B正确;C.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以
的比值增大,故B正确;C.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以![]() 的比值减小,故C错误;D.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,
的比值减小,故C错误;D.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,![]() 的比值减小,故D错误。
的比值减小,故D错误。
故答案为:B;
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于常数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+)。
故答案为:大于;大于。